名校
解题方法
1 . 乙烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知A装置可产生乙烯气体)。
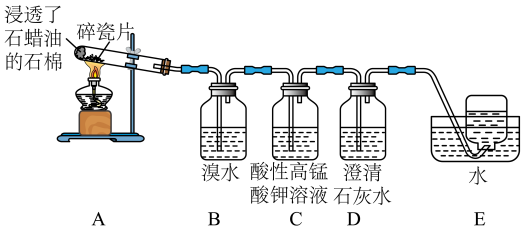
(1)乙烯的电子式为___________ ,其分子空间结构为___________
(2)用化学方程式解释B装置中的实验现象:___________ 。
(3)C装置中的现象是___________ ,其发生反应的反应类型是___________ 。
(4)查阅资料可知。乙烯与酸性高锰酸钾溶液反应产生二氧化碳,则除去甲烷中乙烯的方法是___________
(5)工业上利用乙烯水化制备乙醇,其对应的化学方程式为___________ ;反应类型为___________

(1)乙烯的电子式为
(2)用化学方程式解释B装置中的实验现象:
(3)C装置中的现象是
(4)查阅资料可知。乙烯与酸性高锰酸钾溶液反应产生二氧化碳,则除去甲烷中乙烯的方法是___________
| A.将气体通入水中 | B.将气体通过装溴水的洗气瓶 |
| C.将气体通过装酸性高锰酸钾溶液的洗气瓶 | D.将气体通入氢氧化钠溶液中 |
您最近一年使用:0次
2022-05-16更新
|
946次组卷
|
3卷引用:甘肃省武威第七中学2021-2022学年高一下学期学科竞赛化学试题
2 . 下列由废催化剂(主要含FeBr3及少量溴、苯)制取无水FeCl3的实验装置与原理能达到实验目的的是
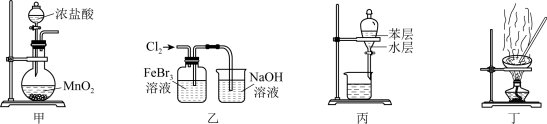
| A.用装置甲制取氯气 |
| B.用装置乙氧化FeBr3溶液中的溴离子 |
| C.用装置丙分离出FeCl3溶液 |
| D.用装置丁蒸干溶液可得无水FeCl3 |
您最近一年使用:0次
2022-01-20更新
|
1080次组卷
|
12卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第3题 化学实验基础知识和技能 -备战2022年高考化学临考题号押题(江苏卷)河南省五市2022届高三下学期第二次联合调研检测(二模)理综化学试题湖南省郴州市第二中学2022届高三下学期期中考试化学试题江苏省常熟中学2023-2024学年高三上学期阶段性抽测一化学试题2024届江苏省常熟市中学高三上学期阶段性抽测一 化学试题江苏省扬州中学2023-2024学年高三下学期阶段练习化学试题江苏省南通市海安市实验中学2023-2024学年高二上学期11月期中化学试题江苏省扬州中学2024届高三下学期3月月考化学试卷江苏省南京市六校联合体2023-2024学年高二下学期四月联考化学试卷
3 . 如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是
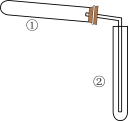

| ①中实验 | ②中现象 | |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
| D | 铜片和浓硫酸混合加热 | 品红溶液褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 亚硝酸钠(NaNO2)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是____ ,装置乙的作用是____ 。
(2)甲中滴入稀硝酸前需先通入N2,原因是____ 。
(3)甲装置中发生反应的离子方程式为____ 。
(4)反应过程中观察到丙中的现象为___ 。
(5)丁中酸性KMnO4的作用是____ 。
(6)设计实验证明丙装置有NaNO2生成____ (写出操作、试剂和现象)。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是
(2)甲中滴入稀硝酸前需先通入N2,原因是
(3)甲装置中发生反应的离子方程式为
(4)反应过程中观察到丙中的现象为
(5)丁中酸性KMnO4的作用是
(6)设计实验证明丙装置有NaNO2生成
您最近一年使用:0次
2022-07-12更新
|
336次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
5 . 风绪小组探究 的相关性质。
的相关性质。
(1)对于 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: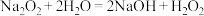 ,
,
①借助资料和实验,发现可以通过 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是_______ 。
②为验证资料的真实性,他们向溶液中滴加适量的酸性 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)_______ 。
(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
①先向沉淀中加入浓盐酸并加热,观察到有_______ 气体产生,发生反应_______ 。证明了猜想正确。
②后续得知,同学在制酸性 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了_______ 沉淀,并证明是 ,反应方程式是
,反应方程式是_______ 。
(3) 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和_______ 有关。
 的相关性质。
的相关性质。(1)对于
 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: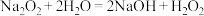 ,
,
①借助资料和实验,发现可以通过
 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是②为验证资料的真实性,他们向溶液中滴加适量的酸性
 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是
 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。①先向沉淀中加入浓盐酸并加热,观察到有
②后续得知,同学在制酸性
 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了 ,反应方程式是
,反应方程式是(3)
 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和
您最近一年使用:0次
解题方法
6 . 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
(1)上述仪器的正确连接顺序为(填各接口处的字母):___________ 。
(2)装置中,饱和食盐水的作用是___________ ;NaOH溶液的作用是___________ 。
(3)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___________ ,反应的化学方程式为___________ 。
(4)写出下列反应的化学方程式
①气体发生装置中进行反应的化学方程式:___________ ;
②NaOH溶液中发生反应的化学方程式:___________ 。
(5)实验室用10mL 12mol/L的浓盐酸和过量二氧化锰反应制取氯气,最终得到224mL的氯气(标准状况),计算该过程中氯气的产率(精确到0.01)___________ 。( )
)

(1)上述仪器的正确连接顺序为(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生。如果有Cl2产生,可观察到
(4)写出下列反应的化学方程式
①气体发生装置中进行反应的化学方程式:
②NaOH溶液中发生反应的化学方程式:
(5)实验室用10mL 12mol/L的浓盐酸和过量二氧化锰反应制取氯气,最终得到224mL的氯气(标准状况),计算该过程中氯气的产率(精确到0.01)
 )
)
您最近一年使用:0次
名校
解题方法
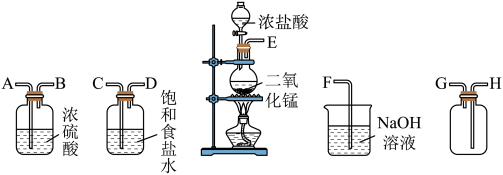
7 . 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图:
(1)MgCO3与稀硫酸反应的离子方程式为____ 。
(2)加入H2O2氧化时,发生反应的化学方程式为____ 。
(3)滤渣2的成分是____ (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;
MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是____ (填化学式)。
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____ 。

(1)MgCO3与稀硫酸反应的离子方程式为
(2)加入H2O2氧化时,发生反应的化学方程式为
(3)滤渣2的成分是
(4)煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;MgSO4+C
 MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;MgSO4+3C
 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次
2022-06-21更新
|
329次组卷
|
2卷引用:陕西省西安高级中学2021-2022学年高一上学期竞赛化学试题
8 . 二氧化钒(VO2) 是一种新型热敏材料。+4 价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料制备VO2,步骤如下:
I. V2O5与6 mol/L盐酸和N2H4·2HCl混合后,微沸数分钟得到VOCl2溶液;
II.将VOCl2溶液与碳酸氢铵溶液混合搅拌后,过滤得到氧钒(IV) 碱式碳酸铵晶体,其化学式为: (NH4)5[(VO)6(CO3)4(OH)9] ·10H2O;
III.将氧钒(IV) 碱式碳酸铵晶体在N2氛围中加热得到VO2。
回答系列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,写出反应的化学方程式_______ 。
(2)VOCl2溶液的制备也可用浓盐酸与V2O5加热,写出反应的离子方程式_______ ;该方法有什么缺点_______ ?
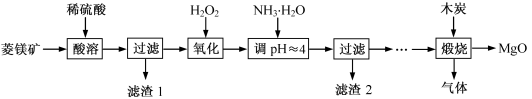
(3)步骤II氧钒(IV)碱式碳酸铵晶体的制备可用下图实验装置实现。
①反应前需通一段时间CO2,其目的是_______ ?
②用字母表示上述装置连接的合理顺序_______ ;饱和NaHCO3溶液的作用是_______ ?
(4)测定VO2粗产品中钒元素的含量。
称量ag样品于锥形瓶中,用20 mL混酸溶解后,加入0.01 mol/L高锰酸钾溶液至稍过量,充分反应后,加2% NaNO2溶液至稍过量,再用尿素可除去过量的NaNO2,最后用bmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为c mL。
已知: + Fe2++ 2H+=VO2++ Fe3++ H2O
+ Fe2++ 2H+=VO2++ Fe3++ H2O
①NaNO2溶液的作用是_______ 。
②求粗产品中钒元素的质量分数为_______ (用含a、b、 c 的式子表示,不要求计算过程)。
I. V2O5与6 mol/L盐酸和N2H4·2HCl混合后,微沸数分钟得到VOCl2溶液;
II.将VOCl2溶液与碳酸氢铵溶液混合搅拌后,过滤得到氧钒(IV) 碱式碳酸铵晶体,其化学式为: (NH4)5[(VO)6(CO3)4(OH)9] ·10H2O;
III.将氧钒(IV) 碱式碳酸铵晶体在N2氛围中加热得到VO2。
回答系列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,写出反应的化学方程式
(2)VOCl2溶液的制备也可用浓盐酸与V2O5加热,写出反应的离子方程式
(3)步骤II氧钒(IV)碱式碳酸铵晶体的制备可用下图实验装置实现。

①反应前需通一段时间CO2,其目的是
②用字母表示上述装置连接的合理顺序
(4)测定VO2粗产品中钒元素的含量。
称量ag样品于锥形瓶中,用20 mL混酸溶解后,加入0.01 mol/L高锰酸钾溶液至稍过量,充分反应后,加2% NaNO2溶液至稍过量,再用尿素可除去过量的NaNO2,最后用bmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为c mL。
已知:
 + Fe2++ 2H+=VO2++ Fe3++ H2O
+ Fe2++ 2H+=VO2++ Fe3++ H2O①NaNO2溶液的作用是
②求粗产品中钒元素的质量分数为
您最近一年使用:0次
解题方法
9 . 实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
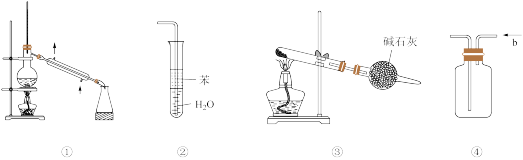

| A.装置①常用于分离互溶的液体混合物 |
| B.装置②可用于吸收HCl气体,并防止倒吸 |
| C.以NH4Cl为原料,装置③可用于实验室制备少量NH3 |
| D.装置④b口进气可收集O2、NH3等气体 |
您最近一年使用:0次
名校
解题方法
10 . 铜是生活中常见的金属,以铜为原料进行如下实验。回答下列问题:
Ⅰ.制备
(1)利用铜与浓硫酸制备 ,适宜的装置是
,适宜的装置是_______ (从A、B、C中选择),该装置内发生的化学方程式为_______ 。
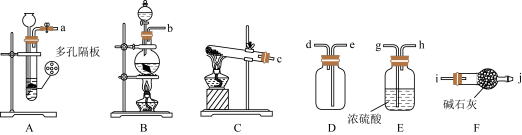
(2)收集干燥的 ,所需装置的接口连接顺序为:发生装置→
,所需装置的接口连接顺序为:发生装置→_______ (填小写字母)。
(3)反应后,发生装置中未观察到蓝色溶液,原因是_______ 。
Ⅱ.探究温度对铜与过氧化氢反应的影响
向10mL30%的 溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为
溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。
(4)写出生成 的离子方程式
的离子方程式_______ 。
(5)学习小组提出猜想:升高温度, 催化能力增强,该小组设计如下实验验证猜想。
催化能力增强,该小组设计如下实验验证猜想。
①小组同学认为实验1~3的结果,不能证明猜想成立,理由是_______ 。
②为进一步验证猜想,完善实验4~6的方案(答案填在答题卡上)_______ 。小组同学结合实验1~6,判断猜想成立,依据是_______ 。
Ⅰ.制备

(1)利用铜与浓硫酸制备
 ,适宜的装置是
,适宜的装置是
(2)收集干燥的
 ,所需装置的接口连接顺序为:发生装置→
,所需装置的接口连接顺序为:发生装置→(3)反应后,发生装置中未观察到蓝色溶液,原因是
Ⅱ.探究温度对铜与过氧化氢反应的影响
向10mL30%的
 溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为
溶液中滴加1mL3mol/L硫酸,将光洁无锈的铜丝置于其中,铜丝表面产生气泡并逐渐变多,剩余溶液呈蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。(4)写出生成
 的离子方程式
的离子方程式(5)学习小组提出猜想:升高温度,
 催化能力增强,该小组设计如下实验验证猜想。
催化能力增强,该小组设计如下实验验证猜想。| 实验序号 | 30%H2O2(mL) | 1mol/LCuSO4(mL) | 水(mL) | 水浴温度(℃) | 3min时生成O2的平均速率(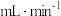 ) ) |
| 1 | 10 | 1 | 1 | 20 | 2.4 |
| 2 | 10 | 1 | 1 | 30 | 9 |
| 3 | 10 | 1 | 1 | 40 | 90 |
| 4 | 10 | 0 | 2 | 20 | A1 |
| 5 | A2 | ||||
| 6 | 10 | 0 | 2 | 40 | A3 |
②为进一步验证猜想,完善实验4~6的方案(答案填在答题卡上)
您最近一年使用:0次
2022-04-15更新
|
1537次组卷
|
9卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题广东省佛山市普通高中2022届高三教学质量检测(二)化学试题广东省佛山市2022届高三下学期4月第二次教学质量监测(二模)化学试题(已下线)押全国卷理综第26题 实验综合-备战2022年高考化学临考题号押题(全国卷)(已下线)押广东卷化学第17题 化学实验综合题-备战2022年高考化学临考题号押题(广东卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题甘肃省兰州市外国语高级中学2022-2023学年高三上学期第二次考试化学试题湖南省湘潭市第一中学2023届高三上学期第五次月考化学试题广东省广州市玉岩中学2024届高三上学期10月月考化学试题



