解题方法
1 . 污染物光催化降解是重要的环境保护研究方向之一,近年来,铋系化合物因其种类繁多、结构可控及光催化性能良好等特点,已经成为光催化剂家族中的重要成员。某课题组研究结果表明,铁酸铋( )在强氧化剂过二硫酸钾(
)在强氧化剂过二硫酸钾( )的协同作用下,对抗生素类污染物环丙沙星的去除具有良好的光催化效果。
)的协同作用下,对抗生素类污染物环丙沙星的去除具有良好的光催化效果。
(1)过二硫酸根离子的结构简式为_______ ;其中硫元素的化合价为_______ 。
(2)污染物光催化降解机理研究显示,过二硫酸根离子的协同作用主要体现在将反应体系中所产生的 转化为
转化为 ,同时,过二硫酸根离子转化为硫酸根离子与具有较高反应活性的硫酸根自由基离子,写出反应的离子方程式
,同时,过二硫酸根离子转化为硫酸根离子与具有较高反应活性的硫酸根自由基离子,写出反应的离子方程式________ 。
(3)通常可基于氧化还原滴定法准确分析过二硫酸盐工业产品的含量。某过二硫酸钾样品分析操作过程如下:准确称取0.2800g样品于30mL去离子水中溶解,并加入4g碘化钾,封闭后混合均匀,在黑暗处放置30min后,加入2mL冰乙酸及20mL去离子水,用0.1000mol/L的硫代硫酸钠标准溶液滴定至终点。同时,进行空白实验,除不加入过二硫酸钾样品外,空白实验中其他操作及所加入试剂的种类与量(标准滴定溶液除外)与样品测定实验相同(已知:过二硫酸钾的相对分子质量为270.4)。
①该操作过程中加入指示剂的名称是_______ 。
②滴定终点现象为_______ 。
③空白实验的目的是_______ 。
④若样品分析与空白实验中硫代硫酸钠标准溶液的消耗体积分别为19.80mL及0.20mL,请计算该样品中过二硫酸钾的质量分数______ 。
 )在强氧化剂过二硫酸钾(
)在强氧化剂过二硫酸钾( )的协同作用下,对抗生素类污染物环丙沙星的去除具有良好的光催化效果。
)的协同作用下,对抗生素类污染物环丙沙星的去除具有良好的光催化效果。(1)过二硫酸根离子的结构简式为
(2)污染物光催化降解机理研究显示,过二硫酸根离子的协同作用主要体现在将反应体系中所产生的
 转化为
转化为 ,同时,过二硫酸根离子转化为硫酸根离子与具有较高反应活性的硫酸根自由基离子,写出反应的离子方程式
,同时,过二硫酸根离子转化为硫酸根离子与具有较高反应活性的硫酸根自由基离子,写出反应的离子方程式(3)通常可基于氧化还原滴定法准确分析过二硫酸盐工业产品的含量。某过二硫酸钾样品分析操作过程如下:准确称取0.2800g样品于30mL去离子水中溶解,并加入4g碘化钾,封闭后混合均匀,在黑暗处放置30min后,加入2mL冰乙酸及20mL去离子水,用0.1000mol/L的硫代硫酸钠标准溶液滴定至终点。同时,进行空白实验,除不加入过二硫酸钾样品外,空白实验中其他操作及所加入试剂的种类与量(标准滴定溶液除外)与样品测定实验相同(已知:过二硫酸钾的相对分子质量为270.4)。
①该操作过程中加入指示剂的名称是
②滴定终点现象为
③空白实验的目的是
④若样品分析与空白实验中硫代硫酸钠标准溶液的消耗体积分别为19.80mL及0.20mL,请计算该样品中过二硫酸钾的质量分数
您最近一年使用:0次
2 . 二氧化钒(VO2) 是一种新型热敏材料。+4 价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料制备VO2,步骤如下:
I. V2O5与6 mol/L盐酸和N2H4·2HCl混合后,微沸数分钟得到VOCl2溶液;
II.将VOCl2溶液与碳酸氢铵溶液混合搅拌后,过滤得到氧钒(IV) 碱式碳酸铵晶体,其化学式为: (NH4)5[(VO)6(CO3)4(OH)9] ·10H2O;
III.将氧钒(IV) 碱式碳酸铵晶体在N2氛围中加热得到VO2。
回答系列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,写出反应的化学方程式_______ 。
(2)VOCl2溶液的制备也可用浓盐酸与V2O5加热,写出反应的离子方程式_______ ;该方法有什么缺点_______ ?
(3)步骤II氧钒(IV)碱式碳酸铵晶体的制备可用下图实验装置实现。
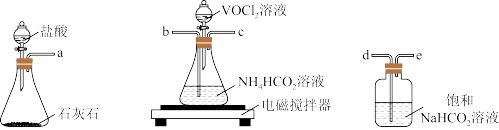
①反应前需通一段时间CO2,其目的是_______ ?
②用字母表示上述装置连接的合理顺序_______ ;饱和NaHCO3溶液的作用是_______ ?
(4)测定VO2粗产品中钒元素的含量。
称量ag样品于锥形瓶中,用20 mL混酸溶解后,加入0.01 mol/L高锰酸钾溶液至稍过量,充分反应后,加2% NaNO2溶液至稍过量,再用尿素可除去过量的NaNO2,最后用bmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为c mL。
已知: + Fe2++ 2H+=VO2++ Fe3++ H2O
+ Fe2++ 2H+=VO2++ Fe3++ H2O
①NaNO2溶液的作用是_______ 。
②求粗产品中钒元素的质量分数为_______ (用含a、b、 c 的式子表示,不要求计算过程)。
I. V2O5与6 mol/L盐酸和N2H4·2HCl混合后,微沸数分钟得到VOCl2溶液;
II.将VOCl2溶液与碳酸氢铵溶液混合搅拌后,过滤得到氧钒(IV) 碱式碳酸铵晶体,其化学式为: (NH4)5[(VO)6(CO3)4(OH)9] ·10H2O;
III.将氧钒(IV) 碱式碳酸铵晶体在N2氛围中加热得到VO2。
回答系列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,写出反应的化学方程式
(2)VOCl2溶液的制备也可用浓盐酸与V2O5加热,写出反应的离子方程式
(3)步骤II氧钒(IV)碱式碳酸铵晶体的制备可用下图实验装置实现。

①反应前需通一段时间CO2,其目的是
②用字母表示上述装置连接的合理顺序
(4)测定VO2粗产品中钒元素的含量。
称量ag样品于锥形瓶中,用20 mL混酸溶解后,加入0.01 mol/L高锰酸钾溶液至稍过量,充分反应后,加2% NaNO2溶液至稍过量,再用尿素可除去过量的NaNO2,最后用bmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为c mL。
已知:
 + Fe2++ 2H+=VO2++ Fe3++ H2O
+ Fe2++ 2H+=VO2++ Fe3++ H2O①NaNO2溶液的作用是
②求粗产品中钒元素的质量分数为
您最近一年使用:0次
解题方法
3 . 实验室现有质量分数为36.5%、密度为1.19g·cm-3的浓盐酸,回答下列问题:
(1)浓盐酸的物质的量浓度为___________ mol·L-1。
(2)某化学兴趣小组进行盐酸性质的实验探究时,需要100mL 1mol·L-1稀盐酸,则需用量筒量取___________ mL的浓盐酸,量取浓盐酸所用的量筒的规格为___________ (填标号)。
A.10mL B.25mL C.50mL D.100mL
(3)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有___________ 。
(4)下列情况对所配制的稀盐酸浓度有何影响。
①所用的浓盐酸长时间放置在密封不好的容器中:___________ (填“偏大”“偏小”或“无影响”,下同)。
②将溶液注入未经干燥的容量瓶中。___________
③转移溶液时用过的烧杯、玻璃棒未洗涤:___________ 。
④定容时俯视刻度线:___________ 。
⑤量取浓盐酸时仰视刻度线:___________
(1)浓盐酸的物质的量浓度为
(2)某化学兴趣小组进行盐酸性质的实验探究时,需要100mL 1mol·L-1稀盐酸,则需用量筒量取
A.10mL B.25mL C.50mL D.100mL
(3)整个实验中用到的玻璃仪器除烧杯、玻璃棒、量筒外还有
(4)下列情况对所配制的稀盐酸浓度有何影响。
①所用的浓盐酸长时间放置在密封不好的容器中:
②将溶液注入未经干燥的容量瓶中。
③转移溶液时用过的烧杯、玻璃棒未洗涤:
④定容时俯视刻度线:
⑤量取浓盐酸时仰视刻度线:
您最近一年使用:0次
解题方法
4 . 完成下列问题
Ⅰ.化合物X,Y,Z含有相同元素,其中一种元素为金属。分别将其隔绝空气煅烧,完全分解后得到固体剩余物和气体(反应①~③)。所得数据如下表。
(1)通过计算和推理,求出X,Y,Z的化学式。X_______ 、Y_______ 、Z_______
(2)写出反应②的方程式_______ 。
Ⅱ.化合物Z和NO在光照条件下经两步反应生成暗绿色挥发性固体A,已知总反应物质的量比为1∶6(反应④)。反应经过一个中间产物B( )。
)。
(3)写出A和B的化学式。A_______ ,B_______
Ⅲ.化合物Z和 在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧
在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧 反应生成暗红色粉末C(
反应生成暗红色粉末C(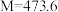 )。已知C中存在
)。已知C中存在 单元以六齿配体形式存在。
单元以六齿配体形式存在。
(4)给出C的化学式_______ ,画出C的结构_______ 。
Ⅳ.化合物Z的类似物D为淡黄色液体。D与 在THF中反应后,再在
在THF中反应后,再在 中与
中与 反应生成化合物E(
反应生成化合物E(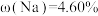 )。D的三聚物F与KOH在
)。D的三聚物F与KOH在 中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与
中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与 在
在 中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与
中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与 在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(
在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(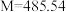 ,反应⑦),I易升华,在1810和
,反应⑦),I易升华,在1810和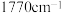 存在
存在 键的吸收峰。
键的吸收峰。
(5)写出D、E、F、G、H、I的化学式。D_______ ,E_______ ,F_______ ,G_______ ,H_______ ,I_______
(6)写出反应⑤⑦的方程式。⑤_______ ,⑦_______
Ⅰ.化合物X,Y,Z含有相同元素,其中一种元素为金属。分别将其隔绝空气煅烧,完全分解后得到固体剩余物和气体(反应①~③)。所得数据如下表。
| 物质 | 原物质质量/g | 固体剩余物质量/g | 气体体积/mL(标况) |
| X | 1.000 | 0.617 | 194.8 |
| Y | 1.000 | 0.497 | 313.3 |
| Z | 1.000 | 0.282 | 574.4 |
(2)写出反应②的方程式
Ⅱ.化合物Z和NO在光照条件下经两步反应生成暗绿色挥发性固体A,已知总反应物质的量比为1∶6(反应④)。反应经过一个中间产物B(
 )。
)。(3)写出A和B的化学式。A
Ⅲ.化合物Z和
 在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧
在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧 反应生成暗红色粉末C(
反应生成暗红色粉末C(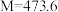 )。已知C中存在
)。已知C中存在 单元以六齿配体形式存在。
单元以六齿配体形式存在。(4)给出C的化学式
Ⅳ.化合物Z的类似物D为淡黄色液体。D与
 在THF中反应后,再在
在THF中反应后,再在 中与
中与 反应生成化合物E(
反应生成化合物E(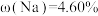 )。D的三聚物F与KOH在
)。D的三聚物F与KOH在 中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与
中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与 在
在 中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与
中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与 在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(
在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(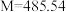 ,反应⑦),I易升华,在1810和
,反应⑦),I易升华,在1810和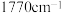 存在
存在 键的吸收峰。
键的吸收峰。(5)写出D、E、F、G、H、I的化学式。D
(6)写出反应⑤⑦的方程式。⑤
您最近一年使用:0次
5 . 一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:

(1)反应反应物为________ 化学方程式为________ 。
(2)反应达到化学平衡的时间内的平均反应速率v(N)=________ 。
(3)4min时,正、逆反应速率的大小关系为v正________ v逆(填“>”“<”或“=”);
(4)一定温度下,将一定量的N2和H2充入固定容积催化剂的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。下列描述能说明该可逆反应达到化学平衡状态的有
2NH3(g)。下列描述能说明该可逆反应达到化学平衡状态的有________ (填序号)。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3molH-H键断裂,有6molN-H键形成
D.c(N2)︰c(H2)︰c(NH3)=1︰3︰2
E.NH3的质量分数不再改变
(5)能加快反应速率的措施是________ (填序号)
①升高温度
②容器容积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂

(1)反应反应物为
(2)反应达到化学平衡的时间内的平均反应速率v(N)=
(3)4min时,正、逆反应速率的大小关系为v正
(4)一定温度下,将一定量的N2和H2充入固定容积催化剂的密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g)。下列描述能说明该可逆反应达到化学平衡状态的有
2NH3(g)。下列描述能说明该可逆反应达到化学平衡状态的有A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3molH-H键断裂,有6molN-H键形成
D.c(N2)︰c(H2)︰c(NH3)=1︰3︰2
E.NH3的质量分数不再改变
(5)能加快反应速率的措施是
①升高温度
②容器容积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂
您最近一年使用:0次
解题方法
6 . Ⅰ.颜料是指不溶解、只能以微粒状态分散于粘合剂中的着色剂。颜料混合时的三原色是红、黄、蓝,通过三原色可以调出其他所有颜色。物质A,B,C的溶液颜色类似于这三种颜色。
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
(1)①推出物质A,B,C,X,Y,Z的化学式,A______ ,B______ ,C______ ,X______ ,Y______ ,Z______
②写出反应①、②、④、⑤的方程式。①______ ,②______ ,④______ ,⑤______
(2)指出物质A、B、C的颜色。A______ ,B______ ,C______ ,
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。 、
、 、
、 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(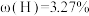 ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
(3)①通过计算和推理写出物质D、E、F的化学式。D______ ,E______ ,F______ ,
②写出反应⑨的方程式。______
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。______ ,
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓
 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。(1)①推出物质A,B,C,X,Y,Z的化学式,A
②写出反应①、②、④、⑤的方程式。①
(2)指出物质A、B、C的颜色。A
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。
 、
、 、
、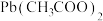 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(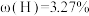 ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。(3)①通过计算和推理写出物质D、E、F的化学式。D
②写出反应⑨的方程式。
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。
您最近一年使用:0次
解题方法
7 . 稀有气体的性质与应用
稀有气体在大功率激光、特殊的光学玻璃等领域具有重大应用前景。Xe的氟化物中XeF2是最有前途的氟化剂,其与氟磺酸(FSO3H)反应产生游离基A(反应一),A双聚成含有非极性键的极性分子B;XeF2水溶液作为强氧化剂可以用来测定I-的含量,在弱酸性介质中氧化I-为IO (反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。
(反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。
(1)写出反应一、二、三的方程式_____ 、_____ 、_____ 。
(2)画出B的立体结构_____ 。
(3)画出C的立体结构,在结构中标出中心原子的杂化方式_____ 。
(4)画出D的立体结构_____ 。
稀有气体在大功率激光、特殊的光学玻璃等领域具有重大应用前景。Xe的氟化物中XeF2是最有前途的氟化剂,其与氟磺酸(FSO3H)反应产生游离基A(反应一),A双聚成含有非极性键的极性分子B;XeF2水溶液作为强氧化剂可以用来测定I-的含量,在弱酸性介质中氧化I-为IO
 (反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。
(反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。(1)写出反应一、二、三的方程式
(2)画出B的立体结构
(3)画出C的立体结构,在结构中标出中心原子的杂化方式
(4)画出D的立体结构
您最近一年使用:0次
8 . 新型含钴催化剂
最近,JohnAnderson课题组合成了一种基于钻元素的均相催化氢化催化剂,它在催化氢化反应中表现出了不同寻常的反应性。请根据所学知识,回答下列问题。
这一催化剂X的合成方法如图所示:
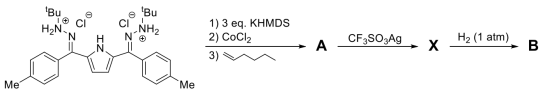
已知KHMDS结构式为 ,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。
,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。
(1)请推断A、B和X的结构_____ 、_____ 、_____ 。
(2)给出合成初始反应物所需的羰基化合物与氨基化合物(只考虑对应的中性反应原料即可,无需将其写成盐酸盐的形式)_____ 。
(3)已知B是催化氢化中的活性物种,在高于0℃的条件下不稳定,尚未分离得到晶体结构。实验发现,只有X才能与 反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同
反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同_____ 。
B与烯烃反应可以将其氢化。通常来说,过渡金属催化剂参与氢化时,按照氧化加成-氢迁移-还原消除的顺序进行,这些反应有些包含氧化还原反应,有些则是按协同反应机理进行。在这一过程中金属原子的氧化态先升高后下降,且反应通常有良好的立体选择性。然而,在B参与的氢化反应中,使用2-甲基-1,3-戊二烯不仅同时得到了顺式和反式4-甲基-2-戊烯,还得到了2-甲基-2-戊烯。电子顺磁共振表明,在反应中金属原子的氧化态没有发生变化。
(4)根据以上信息,请判断这一催化剂进行氢化反应的机理对底物来说属于哪种类型_____ (正离子,负离子,自由基,协同反应),并解释之_____ 。
(5)请给出第一步反应中使用1-己烯的目的_____ 。
最近,JohnAnderson课题组合成了一种基于钻元素的均相催化氢化催化剂,它在催化氢化反应中表现出了不同寻常的反应性。请根据所学知识,回答下列问题。
这一催化剂X的合成方法如图所示:

已知KHMDS结构式为
 ,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。
,A中钻元素含量为11.02%,X中钻元素含量为9.09%,B的化学式与X仅相差两个原子。红外光谱显示,只有B中包含N-H键,而A与X中均不包含N-H键。单晶X射线衍射结果表明,A分子存在对称面与六元螯环,在A与X中,Co的配位数没有发生变化,均为4。(1)请推断A、B和X的结构
(2)给出合成初始反应物所需的羰基化合物与氨基化合物(只考虑对应的中性反应原料即可,无需将其写成盐酸盐的形式)
(3)已知B是催化氢化中的活性物种,在高于0℃的条件下不稳定,尚未分离得到晶体结构。实验发现,只有X才能与
 反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同
反应生成B,而A则不反应。进一步的机理研究表明,X的一个配位位点上的配体发生解离对其反应活性有重要影响。据此,请分析为何A与X的反应活性不同B与烯烃反应可以将其氢化。通常来说,过渡金属催化剂参与氢化时,按照氧化加成-氢迁移-还原消除的顺序进行,这些反应有些包含氧化还原反应,有些则是按协同反应机理进行。在这一过程中金属原子的氧化态先升高后下降,且反应通常有良好的立体选择性。然而,在B参与的氢化反应中,使用2-甲基-1,3-戊二烯不仅同时得到了顺式和反式4-甲基-2-戊烯,还得到了2-甲基-2-戊烯。电子顺磁共振表明,在反应中金属原子的氧化态没有发生变化。
(4)根据以上信息,请判断这一催化剂进行氢化反应的机理对底物来说属于哪种类型
(5)请给出第一步反应中使用1-己烯的目的
您最近一年使用:0次
名校
解题方法
9 . 把一块镁铝合金(质量为m g)投入到50 mL 1 mol/L的HCl溶液里,待合金完全溶解后,再往溶液里加入1 mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示。下列说法中正确的是
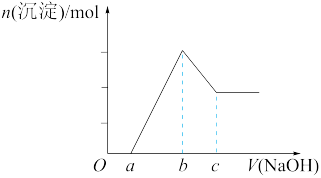

| A.整个反应过程中,主要发生了6个离子反应 |
| B.c值越大,合金中Mg的含量越高 |
| C.b值越大,合金中Al的含量越高 |
| D.根据图象判断,镁铝合金与50 mL 1 mol/L的HCl溶液恰好完全反应 |
您最近一年使用:0次
2021-12-04更新
|
751次组卷
|
8卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题



