1 . I.含氯消毒剂、医用酒精、过氧化物等均能有效灭活病毒,为抗击新型冠状肺炎(COVID—19)作出了贡献。请回答下列问题:
(1)下列物质用作消毒剂时,原理与其它不同的是___ (填字母)。
(2)某兴趣小组欲探究过氧化钠样品是否变质,进行下列操作:取少量样品,溶解,加入___ 溶液(填化学式),振荡,有白色沉淀产生,证明Na2O2已变质。
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与H2O2按一定比例混合后在NaOH溶液中反应制得。制备时ClO2与H2O2完全反应的物质的量理论比为___ 。
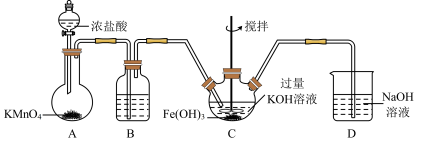
Ⅱ.某化学兴趣小组利用如图装置进行“铁粉与水蒸气反应”的实验,并检验产物的性质(部分夹持装置已略去),请回答下列问题:
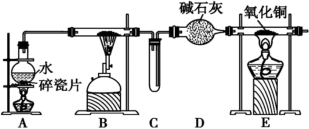
(4)A、B两个装置中应先点燃___ 处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是___ 。
(5)B装置硬质玻璃管中发生反应的化学方程式为___ 。
(6)D装置中盛放的碱石灰的作用是___ 。
(1)下列物质用作消毒剂时,原理与其它不同的是
| A.NaClO | B.O3 | C.医用酒精 | D.H2O2 |
(3)亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,可由ClO2与H2O2按一定比例混合后在NaOH溶液中反应制得。制备时ClO2与H2O2完全反应的物质的量理论比为
Ⅱ.某化学兴趣小组利用如图装置进行“铁粉与水蒸气反应”的实验,并检验产物的性质(部分夹持装置已略去),请回答下列问题:

(4)A、B两个装置中应先点燃
(5)B装置硬质玻璃管中发生反应的化学方程式为
(6)D装置中盛放的碱石灰的作用是
您最近一年使用:0次
2 . 人类社会的发展离不开“求知求真”.某化学兴趣小组以 溶液与
溶液与 溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
(1)实验预测
(2)实验探究
实验一:探究 与
与 能否发生反应①,设计装置如下图,能证明反应已经发生的现象有
能否发生反应①,设计装置如下图,能证明反应已经发生的现象有_______ [已知: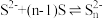 ]。
]。

实验二:探究 与
与 能否发生反应②和③,设计如下实验:
能否发生反应②和③,设计如下实验:
实验结论
 与
与 在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
 溶液与
溶液与 溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。(1)实验预测
| 推测可能发生的反应 | 推测依据 | 预期的实验现象 |
| ①氧化还原反应 |  具有一定的氧化性, 具有一定的氧化性, 具有较强的还原性 具有较强的还原性 | 若 过量,则有淡黄色沉淀(S)生成若 过量,则有淡黄色沉淀(S)生成若 过量,则有黑色沉淀 过量,则有黑色沉淀 |
| ②复分解反应 |  为黑色难溶物, 为黑色难溶物,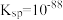 | 有黑色固体生成 |
| ③彻底双水解反应 |  、 、 水解能力均较强 水解能力均较强 | 有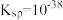 )产生,同时有臭鸡蛋气味的气体(H2S)生成 )产生,同时有臭鸡蛋气味的气体(H2S)生成 |
实验一:探究
 与
与 能否发生反应①,设计装置如下图,能证明反应已经发生的现象有
能否发生反应①,设计装置如下图,能证明反应已经发生的现象有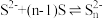 ]。
]。
实验二:探究
 与
与 能否发生反应②和③,设计如下实验:
能否发生反应②和③,设计如下实验:| 实验步骤 | 实验现象 | 实验解释或结论 |
ⅰ.向 饱和 饱和 溶液中,滴加2滴饱和 溶液中,滴加2滴饱和 溶液 溶液 | 有黑色沉淀生成,而后黑色沉淀消失,出现淡黄色沉淀 | 用离子方程式解释黑色沉淀消失的原因: |
ⅱ.将 饱和 饱和 溶液与 溶液与 饱和 饱和 溶液直接混合 溶液直接混合 | 先有黑色和另一种颜色的沉淀生成,而后都变为黑色;同时有臭鸡蛋气味的气体生成 | 试解释:沉淀最终都变为黑色的原因是 |
ⅲ.取ⅱ中最终生成的黑色沉淀样品,用无水乙醇多次洗涤后,干燥称量得 黑色固体,然后在空气中灼烧至恒重 黑色固体,然后在空气中灼烧至恒重 | 灼烧后,所得红棕色固体质量为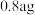 | 经计算判断,黑色固体样品的成份为 |
 与
与 在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
您最近一年使用:0次
名校
解题方法
3 . 农药波尔多液的主要成份是 ,下列两个反应都有
,下列两个反应都有 生成。
生成。
①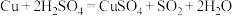 ②
②
请回答下列问题:
(1)从分类角度来看 属于
属于_______ , 属于
属于_______ 。(填序号)
A.氧化物 B.盐 C.碱 D.酸
(2)上述两个反应属于氧化还原反应的是_______ ,其中氧化剂是_______ ,氧化产物是_______ 。
(3)反应①的副产物 是大气污染物,可用
是大气污染物,可用 溶液吸收,该反应的化学方程式是
溶液吸收,该反应的化学方程式是_______ 。
 ,下列两个反应都有
,下列两个反应都有 生成。
生成。①
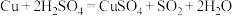 ②
②
请回答下列问题:
(1)从分类角度来看
 属于
属于 属于
属于A.氧化物 B.盐 C.碱 D.酸
(2)上述两个反应属于氧化还原反应的是
(3)反应①的副产物
 是大气污染物,可用
是大气污染物,可用 溶液吸收,该反应的化学方程式是
溶液吸收,该反应的化学方程式是
您最近一年使用:0次
解题方法
4 . 高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定;Fe3+ 遇KSCN溶液显红色。
(1)制备K2FeO4。
①C为制备K2FeO4装置,KOH溶液过量的原因是_______ 。
②D为尾气处理装置,发生反应的离子方程式为_______ 。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有_______ 。该离子的产生_______ (填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ得出氧化性:Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下,配平及完成上述离子方程式_______ 。
_______ +_______H+=_______O2↑+_______ Fe3++_______
+_______H+=_______O2↑+_______ Fe3++_______
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为_______ 。(计算结果保留到0.1%)
(1)制备K2FeO4。

①C为制备K2FeO4装置,KOH溶液过量的原因是
②D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
②方案Ⅱ得出氧化性:Cl2
 (填“>”或“<”)
(填“>”或“<”)(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下,配平及完成上述离子方程式
_______
 +_______H+=_______O2↑+_______ Fe3++_______
+_______H+=_______O2↑+_______ Fe3++_______现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为
您最近一年使用:0次
名校
解题方法
5 . 下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向FeCl3溶液中滴加淀粉KI溶液 | 溶液变成蓝色 | 氧化性:I2 > FeCl3 |
| B | 向硫酸铜溶液中加入小颗粒钠 | 产生红色固体 | 钠比铜活泼 |
| C | 向硫酸亚铁溶液中加入过氧化钠粉末 | 产生红褐色沉淀 | FeSO4已变质 |
| D | 向烧碱样品中滴加氯化钡溶液 | 产生白色沉淀 | 烧碱已变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-05更新
|
92次组卷
|
2卷引用:河南省新乡市长垣驼人新城学校2021-2022学年高一上学期12月月考化学试题
6 .  常作漂白剂、杀菌剂、消毒剂。
常作漂白剂、杀菌剂、消毒剂。 保存不当易吸收空气中的
保存不当易吸收空气中的 而变质。该小组欲进一步测定其变质的程度,他们称取ag样品,设计用如图组合装置来测定该样品中过氧化钠的质量分数。请回答以下问题:
而变质。该小组欲进一步测定其变质的程度,他们称取ag样品,设计用如图组合装置来测定该样品中过氧化钠的质量分数。请回答以下问题:

(1)B中 溶液的作用为
溶液的作用为_______ 。
(2)C装置为 的发生装置,写出
的发生装置,写出 与
与 反应的化学方程式
反应的化学方程式_______ 。
(3)D中NaOH溶液的作用是_______ 。
(4)E装置为排水法收集 的装置,检验所收集的气体为
的装置,检验所收集的气体为 的方法为
的方法为_______ 。
(5)实验结束,样品完全反应,测E中收集到VL的气体,已知此条件下该气体的密度为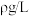 ,则该样品中过氧化钠的质量分数为
,则该样品中过氧化钠的质量分数为_______ ,(用含V、 的字母表示)
的字母表示)
 常作漂白剂、杀菌剂、消毒剂。
常作漂白剂、杀菌剂、消毒剂。 保存不当易吸收空气中的
保存不当易吸收空气中的 而变质。该小组欲进一步测定其变质的程度,他们称取ag样品,设计用如图组合装置来测定该样品中过氧化钠的质量分数。请回答以下问题:
而变质。该小组欲进一步测定其变质的程度,他们称取ag样品,设计用如图组合装置来测定该样品中过氧化钠的质量分数。请回答以下问题:
(1)B中
 溶液的作用为
溶液的作用为(2)C装置为
 的发生装置,写出
的发生装置,写出 与
与 反应的化学方程式
反应的化学方程式(3)D中NaOH溶液的作用是
(4)E装置为排水法收集
 的装置,检验所收集的气体为
的装置,检验所收集的气体为 的方法为
的方法为(5)实验结束,样品完全反应,测E中收集到VL的气体,已知此条件下该气体的密度为
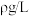 ,则该样品中过氧化钠的质量分数为
,则该样品中过氧化钠的质量分数为 的字母表示)
的字母表示)
您最近一年使用:0次
解题方法
7 . NaOH是重要的化工原料,研究其制备、贮存、检验及应用具有重要意义。
(1)已知:Ⅰ.Na2O+H2O=2NaOH,Ⅱ.2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
①上述反应中属于氧化还原反应的是___ (填编号)。
②工业上制取NaOH不用反应Ⅰ而用反应Ⅱ的原因是___ 。
(2)NaOH在保存程中易变质生成Na2CO3,请写出发生变质的化学方程式:___ 。
(3)探究NaOH样品是否发生变质。
①若NaOH样品已变质,请设计实验方案证明:___ 。
②一定质量的NaOH在变质前后分别与足量的稀硝酸反应,消耗HNO3的质量___ (填“变质前多”“变质后多”或“一样多”)。
(1)已知:Ⅰ.Na2O+H2O=2NaOH,Ⅱ.2NaCl+2H2O
 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。①上述反应中属于氧化还原反应的是
②工业上制取NaOH不用反应Ⅰ而用反应Ⅱ的原因是
(2)NaOH在保存程中易变质生成Na2CO3,请写出发生变质的化学方程式:
(3)探究NaOH样品是否发生变质。
①若NaOH样品已变质,请设计实验方案证明:
②一定质量的NaOH在变质前后分别与足量的稀硝酸反应,消耗HNO3的质量
您最近一年使用:0次
解题方法
8 . 过氧化锶(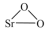 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→____ (选择必要的仪器,可重复选择)。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式____ 。
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
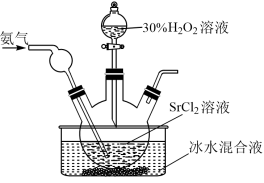
①盛装H2O2溶液的仪器名称为____ 。
②写出该方法制备SrO2·8H2O的离子方程式____ ,NH3的作用是___ 。
③冰水浴的原因是___ 。
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至____ (写出实验现象),记下此时消耗标准溶液的体积,重复实验3~4次,得如表数据:
SrO2·8H2O样品的纯度为____ (已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:

①盛装H2O2溶液的仪器名称为
②写出该方法制备SrO2·8H2O的离子方程式
③冰水浴的原因是
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至
| 平行实验 | 1 | 2 | 3 | 4 |
| 消耗标准溶液体积(mL) | 19.98 | 19.50 | 20.00 | 20.02 |
 =2I-+S4O
=2I-+S4O )
)
您最近一年使用:0次
9 . 矾是一类含硫化合物,一般都含有氢、氧、硫等元素,在生活和生产中有着重要应用。
(1)硫元素在周期表中的位置是___________ ,与硫原子占有相同轨道数目的阳离子有___________ (用微粒符号表示)。
(2)从原子结构的角度解释硫元素的非金属性比氧弱的原因:___________ 。
(3)蓝矾(CuSO4•5H2O)常用于冶金、制农药等。实验室常用蓝矾溶液检验H2S气体,该反应的离子方程式为___________ 。
(4)绿矾(FeSO4•7H2O)水溶液显酸性,在空气中久置出现红褐色的Fe(OH)3沉淀,且溶液的酸性增强,该反应的离子方程式为___________ 。因此绿矾水溶液保存时防止变质可加入试剂为___________ (填化学式)。
(5)已知黄矾[FexS2O9•yH2O]中Fe、S的化合价分别为+3、+6,则x=___________ 。将2.500g样品加热到110℃时,样品失掉部分结晶水,恒重后的固体质量为2.320g;将样品继续高温加热至恒重,得到氧化铁0.800g。黄矾的化学式为___________ 。
(1)硫元素在周期表中的位置是
(2)从原子结构的角度解释硫元素的非金属性比氧弱的原因:
(3)蓝矾(CuSO4•5H2O)常用于冶金、制农药等。实验室常用蓝矾溶液检验H2S气体,该反应的离子方程式为
(4)绿矾(FeSO4•7H2O)水溶液显酸性,在空气中久置出现红褐色的Fe(OH)3沉淀,且溶液的酸性增强,该反应的离子方程式为
(5)已知黄矾[FexS2O9•yH2O]中Fe、S的化合价分别为+3、+6,则x=
您最近一年使用:0次
名校
解题方法
10 . I.NaOH是重要的化工原料,研究其制备、贮存、检验及应用有重要意义。
(1)已知:a.Na2O+H2O=2NaOH;b.2NaCl+2H2O 2NaOH+Cl2↑+H2↑。工业上制取NaOH不用反应a而用反应b的原因是
2NaOH+Cl2↑+H2↑。工业上制取NaOH不用反应a而用反应b的原因是___________ 。
(2)NaOH在保存过程中易变质生成Na2CO3,请写出变质的化学方程式:___________ 。
(3)探究NaOH样品是否发生变质。
①若NaOH样品已变质,请设计实验方案证明:______________________ 。
②一定质量的NaOH在变质前后分别与足量的稀硝酸反应,消耗硝酸的质量___________ (填“变质前多”、“变质后多”或“一样多”)。
II.某溶液的溶质可能由下列离子组成:Cl-、 、
、 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
a. 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
b. 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
c. 将Ⅰ中的沉淀加入足量稀盐酸中,沉淀部分消失,有气体产生。
(4)依据以上实验可以推断,原溶液中一定含有___________ ;一定没有___________ ;可能存在的离子为___________ 。
(1)已知:a.Na2O+H2O=2NaOH;b.2NaCl+2H2O
 2NaOH+Cl2↑+H2↑。工业上制取NaOH不用反应a而用反应b的原因是
2NaOH+Cl2↑+H2↑。工业上制取NaOH不用反应a而用反应b的原因是(2)NaOH在保存过程中易变质生成Na2CO3,请写出变质的化学方程式:
(3)探究NaOH样品是否发生变质。
①若NaOH样品已变质,请设计实验方案证明:
②一定质量的NaOH在变质前后分别与足量的稀硝酸反应,消耗硝酸的质量
II.某溶液的溶质可能由下列离子组成:Cl-、
 、
、 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验: a. 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
b. 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
c. 将Ⅰ中的沉淀加入足量稀盐酸中,沉淀部分消失,有气体产生。
(4)依据以上实验可以推断,原溶液中一定含有
您最近一年使用:0次



