1 . 化学之美美不胜收,值得去品味,去欣赏。下列化学之美与所涉及的化学知识不相符的是
| 选项 | 化学之美 | 化学知识及应用 |
| A | “日照香炉生紫烟”描述了阳光透过水雾形成的唯美景观 | 水雾展于气溶胶,能产生丁达尔现象 |
| B | 氨气形成美丽喷泉 | 氨气极易溶于水 |
| C | 用小球、棍棒组装精美的有机物分子模型 | 乙烯、苯、环己烷均为平面轴对称结构 |
| D | 科学家设计精妙的路线合成新药 | 使用催化剂可使反应向生成所需药物的方向进行 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-13更新
|
886次组卷
|
6卷引用:安徽省舒城中学2021-2022学年高二下学期第二次月考化学试题
安徽省舒城中学2021-2022学年高二下学期第二次月考化学试题广东省佛山市2021-2022学年高三上学期普通高中第一次教学质量检测化学试卷(已下线)第19周 周测卷-备战2022年高考化学周测与晚练(新高考专用)(已下线)押广东卷化学第6题 物质的组成、性质与转化-备战2022年高考化学临考题号押题(广东卷)广东省汕头市2023-2024学年金山中学高三上学期10月阶段考试化学试卷广东省汕头市金山中学2023-2024学年高三上学期10月阶段考试 化学试题
解题方法
2 . 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
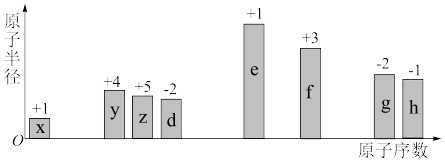
根据判断出的元素回答问题:
(1)f元素的最高价氧化物对应的水化物能溶于e元素的最高价氧化物对应的水化物的水溶液中,请写出该反应的离子方程式:____ 。
(2)z的最简单氢化物与h的单质反应产生z的单质气体和一种遇空气有白雾的气体,写出该反应的化学方程式:____ ,该反应中还原产物是____ 。
(3)元素x与y可形成多种化合物,其中形成一种能催熟果实的气体X。
①气体X的结构简式为____ 。
②若以气体X为主要原料合成乙酸,其合成路线如图所示:

提示:2CH3CHO+O2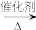 2CH3COOH
2CH3COOH
i.A→B的反应方程式为____ ;
ii.与乙酸互为同分异构体的酯类化合物的结构简式为____ 。

根据判断出的元素回答问题:
(1)f元素的最高价氧化物对应的水化物能溶于e元素的最高价氧化物对应的水化物的水溶液中,请写出该反应的离子方程式:
(2)z的最简单氢化物与h的单质反应产生z的单质气体和一种遇空气有白雾的气体,写出该反应的化学方程式:
(3)元素x与y可形成多种化合物,其中形成一种能催熟果实的气体X。
①气体X的结构简式为
②若以气体X为主要原料合成乙酸,其合成路线如图所示:

提示:2CH3CHO+O2
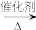 2CH3COOH
2CH3COOHi.A→B的反应方程式为
ii.与乙酸互为同分异构体的酯类化合物的结构简式为
您最近一年使用:0次
3 . 亚硫酰氯(SOCl2)和硫酰氯(SO2Cl2)都是重要的化工原料,均易水解。
I.亚硫酰氯(SOCl2)又名氯化亚矾,熔点-105°C、沸点为77°C,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
(1)用硫磺、液氯和SO3为原料,在一定条件下合成SOCl2,原子利用率可达100%,则三者的物质的量之比为_______ 。
(2)SOCl2水解后无残留物,是较好的脱水剂。某同学设计实验将SOCl2和ZnCl2·xH2O混合物加热来制取无水ZnCl2。
①SOCl2在该实验中的作用是_______ (写出两点)。
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是_______ 。
II.硫酰氯(SO2Cl2)的熔点为-54.1°C,沸点为69.1°C,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100°C以上分解生成SO2和Cl2实验室合成SO2Cl2的原理:SO2(g)+Cl2(g) SO2Cl2(l) ∆H<0,实验装置如图所示(部分夹持装置略去),请回答下列问题:
SO2Cl2(l) ∆H<0,实验装置如图所示(部分夹持装置略去),请回答下列问题:

(3)A、B干燥管中盛有的物质分别是下列_______
(4)去除丙装置可能会发生副反应是_______ 。(用化学方程式表示)。
(5)为了测定SO2Cl2产品纯度(杂质不参与反应),称取mg SO2Cl2产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c mol·L-1 AgNO3溶液滴定反应后的溶液,终点时消耗AgNO3溶液的平均体积为V mL。已知:
①根据上表中各种物质的Ksp,该实验应选择的指示剂为_______ (从下列选项中选择),滴定终点的现象是_______ 。
A. K2SO4 B. K2CrO4 C. K2S D. KBr
②该SO2Cl2产品的纯度为_______ 。
I.亚硫酰氯(SOCl2)又名氯化亚矾,熔点-105°C、沸点为77°C,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
(1)用硫磺、液氯和SO3为原料,在一定条件下合成SOCl2,原子利用率可达100%,则三者的物质的量之比为
(2)SOCl2水解后无残留物,是较好的脱水剂。某同学设计实验将SOCl2和ZnCl2·xH2O混合物加热来制取无水ZnCl2。
①SOCl2在该实验中的作用是
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是
II.硫酰氯(SO2Cl2)的熔点为-54.1°C,沸点为69.1°C,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100°C以上分解生成SO2和Cl2实验室合成SO2Cl2的原理:SO2(g)+Cl2(g)
 SO2Cl2(l) ∆H<0,实验装置如图所示(部分夹持装置略去),请回答下列问题:
SO2Cl2(l) ∆H<0,实验装置如图所示(部分夹持装置略去),请回答下列问题:
(3)A、B干燥管中盛有的物质分别是下列_______
| A.碱石灰、浓硫酸 | B.氯化钙、氯化钙 |
| C.碱石灰、五氧化二磷 | D.碱石灰、碱石灰 |
(5)为了测定SO2Cl2产品纯度(杂质不参与反应),称取mg SO2Cl2产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c mol·L-1 AgNO3溶液滴定反应后的溶液,终点时消耗AgNO3溶液的平均体积为V mL。已知:
| 物质 | Ag2SO4 | AgCl | Ag2CrO4 | Ag2S | AgBr |
| Ksp | 1.2×10-5 | 1.8×10-10 | 2.0×10-12 | 6.3×10-50 | 5.4×10-13 |
| 颜色 | 白色 | 白色 | 砖红色 | 黑色 | 浅黄色 |
A. K2SO4 B. K2CrO4 C. K2S D. KBr
②该SO2Cl2产品的纯度为
您最近一年使用:0次
名校
4 . 二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________ 。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
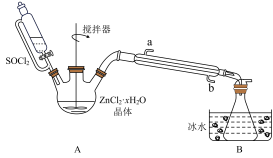
①SOCl2在该实验中的作用_________________________________ ;加热条件下,A装置中总的化学方程式为_________________________________ 。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________ (填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________ (保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________ 。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)

①SOCl2在该实验中的作用
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
| 方案 | 操作 | 现象 | 结论 |
| 方案一 | 往一支试管中滴加 | 若无明显现象 | 则发生了上述副反应 |
| 方案二 | 往另一支试管中滴加 | 则没有发生上述副反应 |
您最近一年使用:0次
5 . 二氯亚砜 (SOCl2) 是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达 100%,则三者的物质的量比为______________ .
(2)甲同学设计如图装置用 ZnCl2 • xH2O 晶体制取无水ZnCl2,回收剩余的SOCl2 并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
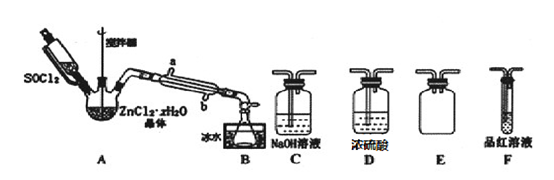
①用原理解释SOCl2在该实验中的作用______________________________________ ;加热条件下,A装置中总的化学方程式为____________________ .
②装置的连接顺序为A→B→_____________________ ;
③实验结束后,为检测 ZnCl2 • xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为_____________ (填序号)
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=______________ (保留小数点后一位),即可证明晶体已完全脱水.
(3)乙同学认为SOCl2还可用作由FeCl3 • 6H2O制取无水FeCl3 的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式______________________ .
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 • 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达 100%,则三者的物质的量比为
(2)甲同学设计如图装置用 ZnCl2 • xH2O 晶体制取无水ZnCl2,回收剩余的SOCl2 并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用
②装置的连接顺序为A→B→
③实验结束后,为检测 ZnCl2 • xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=
(3)乙同学认为SOCl2还可用作由FeCl3 • 6H2O制取无水FeCl3 的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 • 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
| 方案 | 操作 | 现象 | 结论 |
| 方案一 | 往一支试管中滴加 | 若有白色沉淀生成 | 则发生了上述副反应 |
| 方案二 | 往另一支试管中滴加 | 则没有发生上述副反应 |
您最近一年使用:0次
2018-12-18更新
|
360次组卷
|
2卷引用:安徽省定远县重点中学2020届高三4月模拟考试理科综合化学试题
名校
6 . 硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如图所示(部分夹持装置未画出);

已知;
①已知SO2(g)+Cl2(g)=SO2Cl2该反应放热。
②常温下硫酰氯为无色液体,熔点-54.1℃,沸点69.l℃,在潮湿空气中“发烟”生成两种强酸。
③l00℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氧气。
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因_____ (用化学方程式表示)。
(2)装置B中盛放的试剂_____ ;仪器A的名称为_____ 。
(3)装置E的可起到冷凝回流的作用,E中冷凝水的入口是_____ (填“a”或“b”);整套装置存在的缺陷是_____ 。
(4)当装置A中生成氯气1.12L(已折算成标准状况)时,硫酰氯的产率为44%,则最终得到纯净的硫酰氯_____ g。
(5)硫酰氯的工业品中常含有少量硫酸,请你设计实验验证其中含有硫酸_____ (写出实验方案及相关实验现象)。可选试剂:稀盐酸、稀硫酸、BaCl2溶液、蒸馏水、石蕊试液)。

已知;
①已知SO2(g)+Cl2(g)=SO2Cl2该反应放热。
②常温下硫酰氯为无色液体,熔点-54.1℃,沸点69.l℃,在潮湿空气中“发烟”生成两种强酸。
③l00℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氧气。
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因
(2)装置B中盛放的试剂
(3)装置E的可起到冷凝回流的作用,E中冷凝水的入口是
(4)当装置A中生成氯气1.12L(已折算成标准状况)时,硫酰氯的产率为44%,则最终得到纯净的硫酰氯
(5)硫酰氯的工业品中常含有少量硫酸,请你设计实验验证其中含有硫酸
您最近一年使用:0次
名校
解题方法
7 . 化学与生活密切相关。下列说法错误的是
| A.雾和霾是气溶胶,PM2.5被认为是造成雾霾天气的“元凶” |
| B.2021年我国科学家以CO2为原料合成淀粉,为缓解温室效应带来新的希望 |
| C.二氧化硫可用作葡萄酒的食品添加剂,用来杀死有害细菌,防止色素被氧化 |
| D.新型水处理剂Na2FeO4利用其强氧化性对病菌和悬浮物进行高效处理 |
您最近一年使用:0次
2022-02-26更新
|
2359次组卷
|
5卷引用:安徽省六安市晓天中学2021-2022学年高一下学期第一次月考化学试题
安徽省六安市晓天中学2021-2022学年高一下学期第一次月考化学试题湘豫名校2022届高三1月联考理科综合化学试题(已下线)专项01 化学与STSE-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)广东省茂名高州市校际联盟2021-2022学年高一5月联考化学试题黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题
8 . NaH、NaAlH4都是有机合成中的重要还原剂。某课题组设计实验制备NaAlH4,过程如下:
已知:①NaAlH4、NaH遇水都剧烈反应,并产生同一种气体。②共价化合物易溶于乙醚,大部分离子化合物难溶于乙醚。
(1)制备NaH,选择图1中的装置制备NaH(可重复使用):

①图1装置的连接顺序(从左到右)为A→_______ 。
②检验好装置的气密性,点燃酒精灯前需先通一段时间H2,其理由是_______ 。
(2)制备无水AlCl3,装置如图2,已知无水AlCl3在潮湿的空气中极易水解,易升华(178℃)。

①C装置的作用除了干燥Cl2和平衡气压之外,还有_______ 的作用。
②该实验装置存在一处明显的设计缺陷是_______ 。
(3)制备NaAlH4,装置如图3。

步骤I:在N2保护下将块状的NaH粉碎成细小颗粒。
步骤Ⅱ:在三口烧瓶中加入NaH和无水乙醚制成的悬浊液,边搅拌边滴入含AlCl3的乙醚溶液,加入催化剂三乙基铝,继续搅拌直至反应终止,静置。
步骤III:用N2将烧瓶中的物质压出,抽滤,将澄清的滤液蒸发至黏稠状,减压蒸馏得NaAlH4
①AlCl3与NaH反应时,若将AlCl3的乙谜溶液直接滴加到NaH粉末上,NaH的转化率较低的原因是_______ 。
②步骤Ⅱ合成反应的化学方程式为_______ 。
(4)利用铝氢化钠遇水反应生成的氢气的体积测定铝氢化钠样品纯度。现设计如图4的两种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。

①从准确性考虑,最适宜的方案是_______ (填“甲”或“乙”)。
②称取1.5000g铝氢化钠样品与水完全反应后,利用最适宜的装置测得气体在标准状况下的体积为2240ml,则样品中铝氢化钠的质量分数为_______ 。若选择图4另外一装置进行同样操作实验,将会使得样品中铝氢化钠的质量分数_______ (填“偏大”“偏小”或“等于”)。
已知:①NaAlH4、NaH遇水都剧烈反应,并产生同一种气体。②共价化合物易溶于乙醚,大部分离子化合物难溶于乙醚。
(1)制备NaH,选择图1中的装置制备NaH(可重复使用):

①图1装置的连接顺序(从左到右)为A→
②检验好装置的气密性,点燃酒精灯前需先通一段时间H2,其理由是
(2)制备无水AlCl3,装置如图2,已知无水AlCl3在潮湿的空气中极易水解,易升华(178℃)。

①C装置的作用除了干燥Cl2和平衡气压之外,还有
②该实验装置存在一处明显的设计缺陷是
(3)制备NaAlH4,装置如图3。

步骤I:在N2保护下将块状的NaH粉碎成细小颗粒。
步骤Ⅱ:在三口烧瓶中加入NaH和无水乙醚制成的悬浊液,边搅拌边滴入含AlCl3的乙醚溶液,加入催化剂三乙基铝,继续搅拌直至反应终止,静置。
步骤III:用N2将烧瓶中的物质压出,抽滤,将澄清的滤液蒸发至黏稠状,减压蒸馏得NaAlH4
①AlCl3与NaH反应时,若将AlCl3的乙谜溶液直接滴加到NaH粉末上,NaH的转化率较低的原因是
②步骤Ⅱ合成反应的化学方程式为
(4)利用铝氢化钠遇水反应生成的氢气的体积测定铝氢化钠样品纯度。现设计如图4的两种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。

①从准确性考虑,最适宜的方案是
②称取1.5000g铝氢化钠样品与水完全反应后,利用最适宜的装置测得气体在标准状况下的体积为2240ml,则样品中铝氢化钠的质量分数为
您最近一年使用:0次
名校
解题方法
9 . I.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
(1)NaClO具有较强的_______ (填“氧化”或“还原”)性,是常用的消毒剂和漂白剂的有效成分。
(2)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
② 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(3)实验室常用A装置制备氯气,写出该反应的离子方程式_______ 。
(4)C装置的作用是_______ 。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成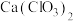 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是_______ 。
②另一个副反应会导致漂白粉中 含量偏高,为避免此副反应的发生,装置的改进措施为
含量偏高,为避免此副反应的发生,装置的改进措施为_______ 。
(1)NaClO具有较强的
(2)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(3)实验室常用A装置制备氯气,写出该反应的离子方程式
(4)C装置的作用是
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
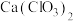 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应会导致漂白粉中
 含量偏高,为避免此副反应的发生,装置的改进措施为
含量偏高,为避免此副反应的发生,装置的改进措施为
您最近一年使用:0次
名校
解题方法
10 . 氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应。某小组设计实验制备氮化锂并测定其纯度,装置如图所示:

实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是___________ 。
(2)安全漏斗中“安全”含义是__________ 。实验室将锂保存在_____ (填“煤油”“石蜡油”或“水”)中。
(3)写出制备N2的化学方程式__________ 。
(4)D装置的作用是____________ 。
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。

打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压________ (填“大于”“小于”或“等于”)外界大气压。
②该Li3N产品的纯度为________ %(只列出含m和V的计算式,不必计算化简)。若 Li3N产品混有Li,则测得纯度_____________ (选填“偏高”“偏低”或“无影响”)。

实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是
(2)安全漏斗中“安全”含义是
(3)写出制备N2的化学方程式
(4)D装置的作用是
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。

打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压
②该Li3N产品的纯度为
您最近一年使用:0次
2020-04-23更新
|
508次组卷
|
5卷引用:安徽省六安市舒城中学2019-2020学年高二下学期期末考试化学试题



