解题方法
1 . 下列实验操作及现象可以达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 验证SO2具有漂白性 | SO2缓慢通入滴有酚酞的NaOH溶液中, 观察溶液颜色变化 |
| B | 探究浓度对反应速率的影响 | 向2支各盛有5mL不同浓度的NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
| C | 证明FeCl 3与KI之间是可逆反应 | 向1mL 0.1mol·L-1FeCl3溶液中滴加2mL 0.1mol·L-1KI溶液, 充分反应, 滴加几滴KSCN溶液后变为红色 |
| D | 除去NaCl固体中混有的少量KNO3杂质 | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 根据实验装置和表内的物质(省略夹持及尾气处理装置,图1中虚线框内的装置是图2),下列能达到相应实验目的的是
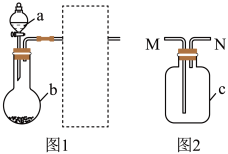

| 选项 | a中的物质 | b中的物质 | 实验目的、试剂和操作 | ||
| 实验目的 | c中的物质 | 进气方向 | |||
| A | 70%的硫酸 | Na2SO3固体 | 验证SO2的漂白性 | 溴水 | M→N |
| B | 饱和食盐水 | 电石 | 验证乙炔的还原性 | 酸性KMnO4溶液 | M→N |
| C | 浓硝酸 | Cu | 支取并收集NO2 | 无 | N→M |
| D | 稀硫酸 | NaHCO3 | 验证碳酸的酸性强于硅酸 | 硅酸钠溶液 | M→N |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-07更新
|
193次组卷
|
4卷引用:选择题6-10
3 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 操作 |
| A | 探究 与 与 反应的限度 反应的限度 | 取 溶液于试管中,加入 溶液于试管中,加入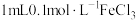 溶液,充分反应后滴入5滴 溶液,充分反应后滴入5滴 溶液 溶液 |
| B | 证明 和浓 和浓 反应生成 反应生成 | 向少量铜与浓 反应后的溶液中慢慢加水,溶液变蓝 反应后的溶液中慢慢加水,溶液变蓝 |
| C | 证明木炭在加热时能与浓硝酸发生反应 | 将灼热的木炭加入到浓硝酸中,有红棕色气体产生 |
| D | 实验室制备乙酸乙酯 | 向试管中依次加入浓硫酸、乙醇、乙酸和碎瓷片,加热,蒸出的乙酸乙酯用饱和碳酸钠溶液收集 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 用下列装置和试剂制取相应气体,能达到相应实验目的的是
| 选项 | 实验目的 | 试剂A | 试剂B |
|
| A | 制Cl2 | 浓盐酸 | Fe2O3 | |
| B | 制NH3 | 浓氨水 | CaCl2 | |
| C | 制NO2 | 稀硝酸 | Cu | |
| D | 制SO2 | 浓硫酸 | Na2SO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-09-11更新
|
436次组卷
|
5卷引用:选择题6-10
名校
解题方法
5 . 根据装置和下表内的物质(省略夹持、净化以及尾气处理装置,图1中虚线框内的装置是图2),其中能完成相应实验目的的是

| 选项 | a中的物质 | b中的物质 | 实验目的、试剂和操作 | ||
| 实验目的 | c中的物质 | 进气方向 | |||
| A | 稀硝酸 | Cu | 收集贮存NO | 水 | N→M |
| B | 浓硝酸 | Na2SO3 | 检验SO2的氧化性 | 品红溶液 | M→N |
| C | 浓氨水 | 碱石灰 | 收集贮存氨气 | 饱和NH4Cl溶液 | N→M |
| D | 浓盐酸 | MnO2 | 检验Cl2的氧化性 | Na2S溶液 | M→N |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-04更新
|
574次组卷
|
3卷引用:选择题6-10
解题方法
6 . 为了保护环境、利用锰资源,可通过如下流程用废旧电池中黑锰粉(含有 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
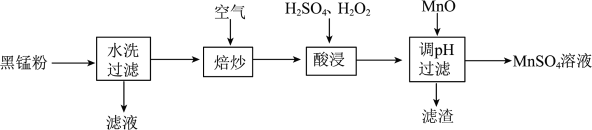
请回答下列问题:
(1)元素Mn在周期表中的位置是_______ , 中含有的化学键类型是
中含有的化学键类型是_______ 。
(2)“焙炒”时 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是_______ ;写出 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式_______ 。
(3)加快“酸浸”速率的措施是_______ (写两条即可);“酸浸”时除了固体溶解、溶液颜色变化外,还可能有的现象是_______ ;“酸浸”中加 的目的是
的目的是_______ 。
(4)“滤渣”的主要成分是_______ 。
(5)请设计实验方案检验所得 溶液中无
溶液中无 :
:_______ (写出操作、现象和结论)。
 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
请回答下列问题:
(1)元素Mn在周期表中的位置是
 中含有的化学键类型是
中含有的化学键类型是(2)“焙炒”时
 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式(3)加快“酸浸”速率的措施是
 的目的是
的目的是(4)“滤渣”的主要成分是
(5)请设计实验方案检验所得
 溶液中无
溶液中无 :
:
您最近一年使用:0次
名校
7 . 无水四氯化锡( )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中 含量。
含量。 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。
②Sn熔点为232℃,无水 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。
回答下列问题:
(1)a管的作用是___________ 。
(2)装置B、C中的试剂分别为___________ 、___________ (填名称)。
(3)为了获得较纯的产品,当D处具支试管中___________ 时,再点燃D处酒精灯。反应制得的产品中可能会含有杂质 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为___________ 。
(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。___________ 。
(5)碘氧化法滴定分析产品中 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中 的质量分数为
的质量分数为___________ (用含a、b、V的代数式表示)。
 )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中 含量。
含量。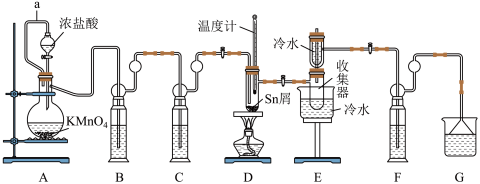
 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。②Sn熔点为232℃,无水
 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。回答下列问题:
(1)a管的作用是
(2)装置B、C中的试剂分别为
(3)为了获得较纯的产品,当D处具支试管中
 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。

(5)碘氧化法滴定分析产品中
 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-05更新
|
256次组卷
|
5卷引用:T15-实验探究题
名校
解题方法
8 . 亚硝酰氯(NOCl)为红褐色液体或黄色气体,其熔点为-64.5℃,沸点为-5.5℃,具有刺鼻恶臭味,遇水剧烈水解,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温、常压下合成。其制备装置如图所示。
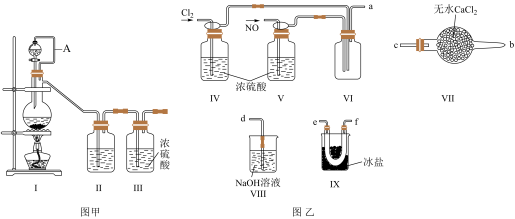
(1)用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:___________ 。
(2)将制得的NO和 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。
①装置连接顺序为a→___________ (按气流自左向右方向,用小写字母表示);
②装置Ⅳ、Ⅴ的作用是___________ 、___________ 。
(3)实验开始时,先通入氯气,再通入NO,原因是___________ 。
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是___________ (填序号)。

(5)制得的NOCl中可能含有少量 杂质,为测定产品纯度进行如下实验:称取3.500g样品溶于NaOH配制成1000.00mL溶液,用移液管取10.00mL溶液,加入几滴
杂质,为测定产品纯度进行如下实验:称取3.500g样品溶于NaOH配制成1000.00mL溶液,用移液管取10.00mL溶液,加入几滴 溶液作指示剂,用足量硝酸酸化的0.020 mol/L
溶液作指示剂,用足量硝酸酸化的0.020 mol/L  溶液进行滴定,消耗
溶液进行滴定,消耗 溶液20.00 mL。
溶液20.00 mL。
①滴定终点的现象是___________ ;
②样品的纯度为___________ %(保留1位小数)。

(1)用图甲中装置制备纯净干燥的原料气,试写出该装置制备氯气的离子方程式:
(2)将制得的NO和
 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。①装置连接顺序为a→
②装置Ⅳ、Ⅴ的作用是
(3)实验开始时,先通入氯气,再通入NO,原因是
(4)有同学认为多余的氯气可以通过下列装置暂时储存然后再利用,下列可以用作氯气的储气装置的是

(5)制得的NOCl中可能含有少量
 杂质,为测定产品纯度进行如下实验:称取3.500g样品溶于NaOH配制成1000.00mL溶液,用移液管取10.00mL溶液,加入几滴
杂质,为测定产品纯度进行如下实验:称取3.500g样品溶于NaOH配制成1000.00mL溶液,用移液管取10.00mL溶液,加入几滴 溶液作指示剂,用足量硝酸酸化的0.020 mol/L
溶液作指示剂,用足量硝酸酸化的0.020 mol/L  溶液进行滴定,消耗
溶液进行滴定,消耗 溶液20.00 mL。
溶液20.00 mL。①滴定终点的现象是
②样品的纯度为
您最近一年使用:0次
9 . 三氯化硼(BCl3)用于制备光导纤维和有机硼化物等,其制备原理为B2O3+3C+3Cl2 2BCl3+3CO。某小组据此设计实验制备BCl3并测定其纯度,装置如图所示(部分夹持装置略)。
2BCl3+3CO。某小组据此设计实验制备BCl3并测定其纯度,装置如图所示(部分夹持装置略)。

已知:BCl3的相对分子质量为117.5,熔点为−107.3℃,沸点为12.5℃,极易水解产生H3BO3[或B(OH)3]和HCl。
实验(一):制备BCl3。
(1)水浴R选择_____ (填“热水浴”或“冰水浴”),盛装碱石灰的仪器是_____ (填名称)。
(2)装置F的作用是______ 。
(3)已知装置A中还原产物为Cr3+,其离子方程式为______ 。
实验(二):测定BCl3产品的纯度。
①准确称取wg产品,置于蒸馏水中,完全水解,并配成250mL溶液;
②准确量取25.00mL溶液于锥形瓶中;
③向其中加入V1mLc1 mol∙L−1AgNO3溶液(过量),然后加入3mL硝基苯(常温常压下,密度为1.205 g∙cm−3),振荡;
④向锥形瓶中滴加3滴FeCl3溶液,然后逐滴加入c2 mol∙L−1KSCN标准溶液滴定过量AgNO3溶液,消耗KSCN标准溶液的体积为V2mL。已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤③中加入硝基苯的目的是______ ;滴定终点的现象是______ 。
(5)该产品中BCl3的质量分数为______ %;如果其他操作都正确,仅滴定管没有用KSCN标准溶液润洗,则测得产品中BCl3的质量分数______ (填“偏高”“偏低”或“无影响”)。
 2BCl3+3CO。某小组据此设计实验制备BCl3并测定其纯度,装置如图所示(部分夹持装置略)。
2BCl3+3CO。某小组据此设计实验制备BCl3并测定其纯度,装置如图所示(部分夹持装置略)。
已知:BCl3的相对分子质量为117.5,熔点为−107.3℃,沸点为12.5℃,极易水解产生H3BO3[或B(OH)3]和HCl。
实验(一):制备BCl3。
(1)水浴R选择
(2)装置F的作用是
(3)已知装置A中还原产物为Cr3+,其离子方程式为
实验(二):测定BCl3产品的纯度。
①准确称取wg产品,置于蒸馏水中,完全水解,并配成250mL溶液;
②准确量取25.00mL溶液于锥形瓶中;
③向其中加入V1mLc1 mol∙L−1AgNO3溶液(过量),然后加入3mL硝基苯(常温常压下,密度为1.205 g∙cm−3),振荡;
④向锥形瓶中滴加3滴FeCl3溶液,然后逐滴加入c2 mol∙L−1KSCN标准溶液滴定过量AgNO3溶液,消耗KSCN标准溶液的体积为V2mL。已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤③中加入硝基苯的目的是
(5)该产品中BCl3的质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
10 . 2021年10月16日,执行神舟十三号载人飞行任务的三名航天员成功进入我国自主建造的天和核心舱。 可用作火箭、导弹推进剂,某小组在实验室制备
可用作火箭、导弹推进剂,某小组在实验室制备 。
。
Ⅰ.实验室制备 (装置如图)。
(装置如图)。
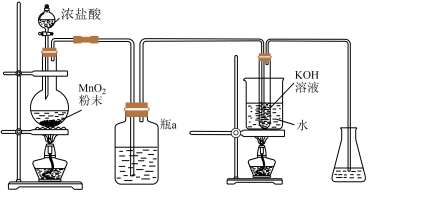
(1)瓶a中的试剂为_______(填序号)。
(2)①根据制备方程式 ,产品的理论产率为
,产品的理论产率为_______ (结果保留3位有效数字)。[产率 ]
]
②实验最终产率小于理论产率,原因可能是_______ (任答一条即可)。
Ⅱ.模拟工业交换膜电解法,高电压下电解 溶液制备
溶液制备 ,进而获得
,进而获得 ,可以提高产率。
,可以提高产率。
(3)实验时,常因电压控制不当,产生副产品 ,写出其总反应的离子方程式:
,写出其总反应的离子方程式:_______ 。
(4)“获取产品”
往电解后的溶液中加入 ,原理为
,原理为 ,
, 。反应结束后,将溶液放到冰水浴中,
。反应结束后,将溶液放到冰水浴中, 后会析出较多的粗产品晶体,这样做是因为(溶解度数据如图):
后会析出较多的粗产品晶体,这样做是因为(溶解度数据如图):
a. 溶解度在相同温度时小于溶液中其他成分;b.
溶解度在相同温度时小于溶液中其他成分;b. 溶解度受温度影响较大,而
溶解度受温度影响较大,而 溶解度受温度影响较小;c.
溶解度受温度影响较小;c. 溶解度
溶解度_______ 。

 可用作火箭、导弹推进剂,某小组在实验室制备
可用作火箭、导弹推进剂,某小组在实验室制备 。
。Ⅰ.实验室制备
 (装置如图)。
(装置如图)。
(1)瓶a中的试剂为_______(填序号)。
| A.饱和食盐水 | B.浓硫酸 | C.饱和碳酸氢钠溶液 | D.浓氨水 |
 ,产品的理论产率为
,产品的理论产率为 ]
]②实验最终产率小于理论产率,原因可能是
Ⅱ.模拟工业交换膜电解法,高电压下电解
 溶液制备
溶液制备 ,进而获得
,进而获得 ,可以提高产率。
,可以提高产率。(3)实验时,常因电压控制不当,产生副产品
 ,写出其总反应的离子方程式:
,写出其总反应的离子方程式:(4)“获取产品”
往电解后的溶液中加入
 ,原理为
,原理为 ,
, 。反应结束后,将溶液放到冰水浴中,
。反应结束后,将溶液放到冰水浴中, 后会析出较多的粗产品晶体,这样做是因为(溶解度数据如图):
后会析出较多的粗产品晶体,这样做是因为(溶解度数据如图):a.
 溶解度在相同温度时小于溶液中其他成分;b.
溶解度在相同温度时小于溶液中其他成分;b. 溶解度受温度影响较大,而
溶解度受温度影响较大,而 溶解度受温度影响较小;c.
溶解度受温度影响较小;c. 溶解度
溶解度
您最近一年使用:0次




