名校
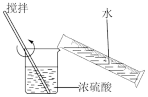
1 . 实验装置不能达到实验目的的是
| A | B | C | D |
|
|
|
|
| 稀释浓硫酸 | 制备并检验 气体 气体 | 用该装置制备少量白色的 沉淀 沉淀 | 吸收NO中的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-30更新
|
882次组卷
|
12卷引用:湖南省绥宁县第一中学2022-2023学年高一下学期学科知识竞赛化学试题
湖南省绥宁县第一中学2022-2023学年高一下学期学科知识竞赛化学试题福建省厦门第一中学2021-2022学年高一上学期12月月考化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖北省襄阳市第一中学2021-2022学年高一下学期3月月考化学试题山西省榆次第一中学校2021-2022学年高一下学期期中线上测试化学试题辽宁省东北师范大学连山实验高中2021-2022学年高一下学期第一次线上考试化学试题(已下线)仿真卷02-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)化学(人教版2019B卷)-学易金卷:2022-2023学年高一下学期期中考前必刷卷河南省驻马店市2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期5月期中考试化学试题安徽省安庆市第九中学2022-2023学年高一下学期期中考试化学试题陕西省咸阳市三原县北城中学2023-2024学年高一下学期第一次月考化学试题
2010高三·湖北·竞赛
解题方法
2 . 化学实验兴趣小组在实验室进行氢气在氯气中的燃烧实验。
(1)设计如下图所示装置I制备和收集干燥纯净的氯气以备后续实验;

烧瓶中发生反应的离子方程式为_______ ;
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;_________
(2)在右图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CuSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。

①检查制取氢气装置气密性的操作方法是____________
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是____________
(3)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示);_______ 、________ 、_______ 、____ ;B组同学向集气瓶中注入适量水,用力振荡后,向其中加入少量Na2S2O3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:①_____________ ②____________
(1)设计如下图所示装置I制备和收集干燥纯净的氯气以备后续实验;

烧瓶中发生反应的离子方程式为
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;
(2)在右图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CuSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。

①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
(3)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示);
您最近一年使用:0次
3 . 研究性学习小组设计了如下图所示实验装置(部分夹持装置已省略)制备NO,并进行NO的检验和性质探究实验。

已知:NO在 溶液中发生反应
溶液中发生反应 (棕色),该反应可以用于检验NO。
(棕色),该反应可以用于检验NO。
(1)仪器a的名称是_______ 。装置A内发生主要反应的离子方程式为_______ 。
(2)实验开始前,向装置中通入一段时间 的目的是
的目的是_______ 。
(3)装置B、C中蒸馏水和无水 的作用分别是
的作用分别是_______ 、_______ 。
(4)装置D中Fe粉与NO以物质的量之比 发生反应,生成
发生反应,生成 和另一种固体产物。该固体产物的化学式为
和另一种固体产物。该固体产物的化学式为_______ 。
(5)进行实验时,装置E中的实验现象为_______ 。

已知:NO在
 溶液中发生反应
溶液中发生反应 (棕色),该反应可以用于检验NO。
(棕色),该反应可以用于检验NO。(1)仪器a的名称是
(2)实验开始前,向装置中通入一段时间
 的目的是
的目的是(3)装置B、C中蒸馏水和无水
 的作用分别是
的作用分别是(4)装置D中Fe粉与NO以物质的量之比
 发生反应,生成
发生反应,生成 和另一种固体产物。该固体产物的化学式为
和另一种固体产物。该固体产物的化学式为(5)进行实验时,装置E中的实验现象为
您最近一年使用:0次
名校
4 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 验证肉桂醛中含碳碳双键 | 向肉桂醛(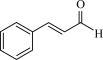 )中加入酸性KMnO4溶液 )中加入酸性KMnO4溶液 | 肉桂醛中含有碳碳双键 |
| B | 比较CuSO4和KMnO4的催化效果 | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液,CuSO4溶液产生气泡速率快 | CuSO4催化H2O2溶液分解效果更好 |
| C | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| D | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-19更新
|
800次组卷
|
2卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
解题方法
5 . 根据下列操作及现象,能达到目的是
| 选项 | 操作及现象 | 实验目的 |
| A | 向20mLNa2CO3和NaOH混合溶液中,滴入几滴酚酞试液,用0.1000mol/L盐酸标准溶液滴定至粉红色 | 测定NaOH的浓度 |
| B | 向溶有SO2的BaCl2溶液中加入Fe(NO3)3溶液,有白色沉淀生成 | 说明 具有强氧化性 具有强氧化性 |
| C | 向5mL0.1mol/LKI溶液中滴加1mL0.1mol/LFeCl3溶液,充分反应后再滴加少量KSCN溶液,溶液变红 | 证明KI与FeCl3的反应属于可逆反应 |
| D | 分别向2mL乙醇和乙二醇中加入一粒绿豆大小的金属钠,乙二醇产生气泡的速度更快 | 证明乙二醇中羟基数目多 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 下列由废催化剂(主要含FeBr3及少量溴、苯)制取无水FeCl3的实验装置与原理能达到实验目的的是
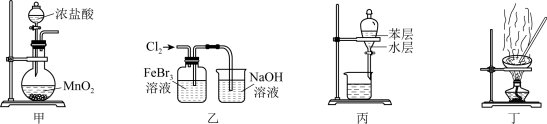
| A.用装置甲制取氯气 |
| B.用装置乙氧化FeBr3溶液中的溴离子 |
| C.用装置丙分离出FeCl3溶液 |
| D.用装置丁蒸干溶液可得无水FeCl3 |
您最近一年使用:0次
2022-01-20更新
|
1051次组卷
|
12卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第3题 化学实验基础知识和技能 -备战2022年高考化学临考题号押题(江苏卷)河南省五市2022届高三下学期第二次联合调研检测(二模)理综化学试题湖南省郴州市第二中学2022届高三下学期期中考试化学试题江苏省常熟中学2023-2024学年高三上学期阶段性抽测一化学试题2024届江苏省常熟市中学高三上学期阶段性抽测一 化学试题江苏省扬州中学2023-2024学年高三下学期阶段练习化学试题江苏省南通市海安市实验中学2023-2024学年高二上学期11月期中化学试题江苏省扬州中学2024届高三下学期3月月考化学试卷江苏省南京市六校联合体2023-2024学年高二下学期四月联考化学试卷
名校
解题方法
7 . 实验室制取并收集氨气。下列装置能达到实验目的的是
A.制取NH3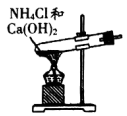 | B.干燥NH3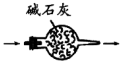 |
C.收集NH3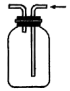 | D.吸收NH3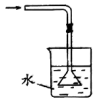 |
您最近一年使用:0次
2021-01-28更新
|
658次组卷
|
6卷引用:山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
解题方法
8 . 为了研究不同浓度硝酸的性质,某小组设计了如下实验(固定装置和尾气处理装置略)。
(1)实验I中氧化剂和还原剂的物质的量之比是多少______ ?
(2)对实验I和实验II发生不同反应的原因提出如下解释:
①极稀的硝酸与金属锌反应时无气体产生,写出此时生成的硝酸盐的化学式______ 。
②浓硝酸具有较强的氧化性,可将NO转化为 ,请写出其反应的化学方程式
,请写出其反应的化学方程式______ 。
(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想:
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色溶液混合而呈现绿色。
溶于浓硝酸,与蓝色溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为绿色的
结合为绿色的 。
。
①向浓硝酸中先通入 ,再滴加少量蓝色
,再滴加少量蓝色 溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为
溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为_______ 、_______ 。
②向蒸馏水中通入 得到无色溶液,向其中滴加蓝色的
得到无色溶液,向其中滴加蓝色的 溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由
溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由______ 。
(4)金可溶于王水(浓盐酸和浓硝酸按体积比3:1混合而成)生成 ,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式
,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式______ ,并分析该反应不直接生成 的原因
的原因______ 。
| 装置 | 编号 | 试剂a | 现象 |
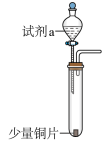 | I | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| II | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
(2)对实验I和实验II发生不同反应的原因提出如下解释:
①极稀的硝酸与金属锌反应时无气体产生,写出此时生成的硝酸盐的化学式
②浓硝酸具有较强的氧化性,可将NO转化为
 ,请写出其反应的化学方程式
,请写出其反应的化学方程式(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想:
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色溶液混合而呈现绿色。
溶于浓硝酸,与蓝色溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为绿色的
结合为绿色的 。
。①向浓硝酸中先通入
 ,再滴加少量蓝色
,再滴加少量蓝色 溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为
溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为②向蒸馏水中通入
 得到无色溶液,向其中滴加蓝色的
得到无色溶液,向其中滴加蓝色的 溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由
溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由(4)金可溶于王水(浓盐酸和浓硝酸按体积比3:1混合而成)生成
 ,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式
,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式 的原因
的原因
您最近一年使用:0次
名校
9 . 利用如图装置完成相应实验,其中收集方法及所用试剂、现象、结论均正确的是

| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NH3 | 酚酞溶液 | 溶液变为红色 | 氨水显碱性 |
| B | NO2 | KI-淀粉溶液 | 溶液变为蓝色 | NO2有还原性 |
| C | SO2 | 溴水 | 溶液褪色 | SO2有还原性 |
| D | Cl2 | 品红溶液 | 溶液褪色 | Cl2有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-18更新
|
222次组卷
|
5卷引用:第32届(2019年)中国化学奥林匹克竞赛湖北赛区预赛试题()
名校
解题方法
10 . 亚硝酸钠(NaNO2)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是____ ,装置乙的作用是____ 。
(2)甲中滴入稀硝酸前需先通入N2,原因是____ 。
(3)甲装置中发生反应的离子方程式为____ 。
(4)反应过程中观察到丙中的现象为___ 。
(5)丁中酸性KMnO4的作用是____ 。
(6)设计实验证明丙装置有NaNO2生成____ (写出操作、试剂和现象)。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是
(2)甲中滴入稀硝酸前需先通入N2,原因是
(3)甲装置中发生反应的离子方程式为
(4)反应过程中观察到丙中的现象为
(5)丁中酸性KMnO4的作用是
(6)设计实验证明丙装置有NaNO2生成
您最近一年使用:0次
2022-07-12更新
|
333次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题