名校
解题方法
1 . 下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
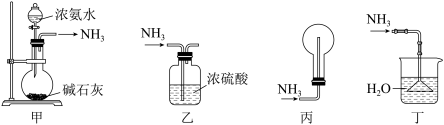
| A.用装置甲制备氨气 | B.用装置乙除去氨气中的少量水 |
| C.用装置丙收集氨气 | D.用装置丁吸收多余的氨气 |
您最近一年使用:0次
2022-04-23更新
|
3555次组卷
|
65卷引用:专题7 本专题达标检测-高中化学必修第二册苏教版2019
专题7 本专题达标检测-高中化学必修第二册苏教版20192015届江苏省连云港等四市高三一模化学试卷2017届河南省濮阳市第一高级中学高三上第二次检测化学试卷2016-2017学年河北省定州中学高二上期中化学试卷山东省烟台市2018届高三上学期期中考试化学试题陕西省西安市第八十三中学2017-2018学年第一学期期末考试高一年级化学试卷【全国百强校】山东省济南外国语学校2017-2018学年高二下学期期末教学质量检测化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2017-2018学年高一下学期期末考试化学试题【全国百强校】安徽省蚌埠市第二中学2018-2019学年高二上学期开学考试化学试题【全国百强校】河北省衡水市武邑中学2018-2019学年高二上学期第一次月考化学试题(已下线)2019年1月10日 《每日一题》人教必修1-氨的性质与实验室制备福建省泉州市永春县第一中学2018-2019学年高一下学期期中考试化学试题江苏省常州高级中学2018-2019学年高一下学期期中考试化学试题湖南省长郡中学2018-2019学年高一下学期期末考试化学试题陕西省渭南韩城市2020届高三上学期第二次月考化学试题2020届高三化学一轮复习 化学基础实验(选择题和大题训练)课时1 利用化学反应制备物质——A学习区 夯实基础(鲁科版必修2)安徽省滁州市明光中学2019-2020学年高一下学期开学考试化学试题(已下线)第6单元 常见的非金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷浙江省富阳中学2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】42.山东省枣庄市2020-2021学年高一上学期期末考试化学试题山东省济南德润高级中学2020-2021学年高一下学期开学考试化学试题黑龙江省大庆实验中学实验一部2020-2021学年高一下学期开学考试化学试题上海市松江区2021届高三二模化学试题江苏省扬州市2020-2021学年高一下学期期中调研化学试题辽宁省阜新市第二高级中学2020-2021学年高一下学期期中考试化学试题黑龙江省双鸭山市第一中学2020-2021学年高一下学期期中考试化学试题宁夏大学附属中学2020-2021学年高一上学期期末考试化学试题黑龙江省哈三中2020-2021学年度高一下学期第一学段考试化学(文科)试题内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第一次月考化学试题四川省仁寿第一中学校北校区2020-2021学年高一下学期期末模拟(7月)考试化学试题吉林省通化县综合高级中学2020-2021学年高一下学期期末考试化学试题(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 天津市南开区2021-2022学年高三上学期期中考试化学试题云南省玉溪市峨山彝族自治县第一中学2021-2022学年高一下学期3月月考化学试题重庆市名校联盟2021-2022学年高一下学期第一次联合考试化学试题广东省汕头市金山中学2021-2022学年高一下学期期中考试化学试题上海市宜川中学2021-2022学年高一下学期期中考试化学试题(已下线)【期末复习】必刷题(1)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)广东省珠海市三校2021-2022学年高一下学期期中联考化学试题(已下线)【教材实验热点】08 氨气的实验室制取及性质的研究(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)江苏省盐城市响水中学2021-2022学年高一下学期期中考试化学试题安徽省亳州市第二中学2021-2022学年高一下学期期末考试化学试题(已下线)微专题44 以气体制备为主体的实验-备战2023年高考化学一轮复习考点微专题广东省梅州市大埔县虎山中学2022-2023学年高三上学期第一次段考(8月)化学试题贵州省贵阳市白云区第二高级中学2021-2022学年高一下学期期中考试化学试题甘肃省白银市白银区大成学校2021-2022学年高一下学期期中考试化学试题(已下线)3.2.2 铵盐和硝酸-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)湖北省武汉海淀外国语实验学校2022-2023学年高三上学期10月月考化学试题黑龙江省海伦市国际双语学校2021-2022学年高一下学期期中测试化学试题湖南省益阳市安化县第二中学2022-2023学年高一下学期4月月考化学试题上海市松江区2023届高三二模测试化学试题福建省漳州市华安县第一中学2022-2023学年高一下学期期中考试化学试题(已下线)专题06 化学实验基础7.2.1氨气(课中)-2019苏教版必修2课前课中课后(已下线)2023年广东卷高考真题变式题(选择题1-5)(已下线)微专题 常见气体的实验室制备、净化和收集吉林省长春市新解放学校2022-2023学年高一下学期7月期末考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期期末考试化学试题01 2024年常熟省中高一3月月考河北省唐山市开滦第二中学2023-2024学年高一下学期4月月考化学试题湖南省2024届高三下学期高考仿真模拟卷(四)化学试题
名校
解题方法
2 . 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取二氧化碳、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是()
A.制取二氧化碳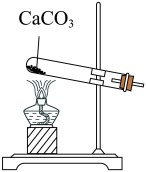 |
B.制取NaHCO3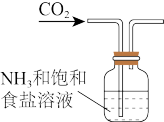 |
C.分离NaHCO3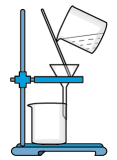 |
D.干燥NaHCO3 |
您最近一年使用:0次
2020-03-17更新
|
161次组卷
|
4卷引用:第一章 认识化学科学(能力提升)-2020-2021学年高一化学上学期必修第一册《单元测试定心卷》 (鲁科版2019)
(已下线)第一章 认识化学科学(能力提升)-2020-2021学年高一化学上学期必修第一册《单元测试定心卷》 (鲁科版2019)山东省邹平一中2018-2019学年高一第三次阶段性化学考试试题宁夏回族自治区石嘴山市第三中学2021届高三上学期期中化学试题新疆五家渠市兵团二中金科实验中学2021-2022学年高一下学期开学考试化学试题
真题
名校
3 . 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
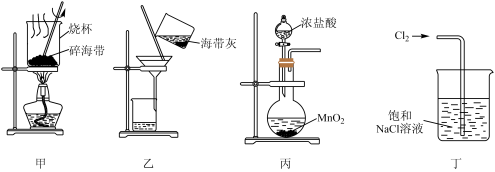

| A.用装置甲灼烧碎海带 |
| B.用装置乙过滤海带灰的浸泡液 |
| C.用装置丙制备用于氧化浸泡液中I−的Cl2 |
| D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气 |
您最近一年使用:0次
2018-06-10更新
|
11754次组卷
|
84卷引用:高一必修第二册(人教2019版)第八章 化学与可持续发展 素养检测
高一必修第二册(人教2019版)第八章 化学与可持续发展 素养检测2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题黑龙江省青冈县一中2017-2018学年高一下学期期末考试化学试题江西省南昌三中2019届高二下期末考试 化学(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础【全国百强校】黑龙江省哈尔滨市第三中学2017-2018学年高二下学期期末考试化学试题江苏省盐城市田家炳中学2019届高三上学期开学考试化学试题陕西省城固县第一中学2019届高三上学期第一次月考化学试题辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题湖北省汉川市第二中学2017-2018学年高一下学期期末考试化学试题甘肃省师范大学附属中学2019届高三上学期第一次月考化学试题辽宁省葫芦岛协作校2019届高三上学期第一次月考化学试题甘肃省武威市第二中学2019届高三上学期第二次(10月)月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期9月模块诊断化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题河南省郑州市实验中学2019届高三上学期期中考试化学试题【全国百强校】山东省山东师范大学附属中学2019届高三上学期第五次模拟考试化学试题山西省长治二中2018-2019学年高一下学期第一次月考化学试题【市级联考】陕西省榆林市2019届高三下学期高考模拟第三次测试理科综合化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高一下学期4月月考化学试题(已下线)2019年5月20日 《每日一题》 必修2 海带提碘步步为赢 高一化学暑假作业:作业十六 开发利用金属矿物和海水资源【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题黑龙江省大庆市第四中学2018-2019学年高一下学期第三次月考化学试题四川省武胜县烈面中学校2018届高三9月入学考试化学试题湖北省利川市第三中学2019届高三一模化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)(已下线)专题10.2 物质的分离、提纯、检验与鉴别(练)-《2020年高考一轮复习讲练测》(已下线)专题10.2 物质的分离、提纯、检验与鉴别(讲)-《2020年高考一轮复习讲练测》河南省南阳市2020届高三上学期期中质量评估化学试题(已下线)考点20 化学基础实验——《备战2020年高考精选考点专项突破题集》福建省莆田第二十五中学2020届高三上学期期末考试化学试题2020届人教版高中化学高三专题基础复习专题1《从实验学化学》测试卷上海市宝山区2020届高三上学期第一次模拟考试(等级考)化学试题广东省2020年普通高中学业水平考试化学合格性考试模拟试题(五)新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题(已下线)专题3.6 金属材料和无机非金属材料 海水的开发利用 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》江苏省南通市启东市吕四中学2020届高三第一次质量检测化学试题四川省广安市邻水县四川省邻水中学2019-2020学年高一下学期期中考试化学试题(已下线)第02讲 物质的分离和提纯(精讲)——2021年高考化学一轮复习讲练测四川省成都市龙泉中学2021届高三上学期开学考试化学试题(已下线)第6单元 常见的非金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律微项目 海带提碘与海水提溴高一必修第一册(苏教2019版)专题3 C 高考挑战区 过模拟 2年模拟精编精练江苏省扬州市江都区大桥高级中学2021届高三上学期期初调研化学试题高一必修第一册(苏教2019)专题3 第三单元 海洋化学资源的综合利用3江苏省邗江中学2020-2021学年高一上学期期中考试化学试题山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题山西省实验中学2019届高三上学期第四次月考化学试题江苏省泰州中学2021届高三上学期第二次月考化学试题专题3 第三单元综合拔高练-高中化学苏教2019版必修第一册(人教版2019)必修第二册 第八章 化学与可持续发展 第一节 自然资源的开发利用云南省普洱市景东县第一中学2021届高三上学期期末考试化学试题(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)重庆市永川景圣中学2020-2021学年高三上学期第二次月考化学试题吉林省通化县综合高级中学2020-2021学年高一下学期期末考试化学试题内蒙古巴彦淖尔市乌拉特前旗第一中学2020-2021学年高二下学期期末考试化学试题(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)内蒙古包头市2022届高三上学期起点调研考试化学试题(已下线)课时52 物质的分离、提纯和检验-2022年高考化学一轮复习小题多维练(全国通用)重庆市开州中学高 2021-2022学年高三上学期10月月考化学试题湖北省武汉市蔡甸区实验高级中学2020-2021学年高二上学期10月联合考试化学试题福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题山东省济南市莱芜第一中学2021-2022学年高三上学期期中考试化学试题福建省厦门市翔安第一中学2021-2022学年高一下学期第一次月考(3月)化学试题湖南省浏阳市第一中学2022届高三下学期期中考试化学试题云南省昭通市永善、绥江县2021-2022学年高一上学期期末考试化学试题山东省菏泽市单县第五中学2021-2022学年高一下学期第一次段考化学(A)试题新疆叶城县第八中学2021-2022学年高三上学期第二次月考化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题四川省广安市育才学校2022-2023学年高一上学期9月月考化学试题江苏省扬州中学2022-2023学年高一上学期期中检测化学试题湖南省长沙市同升湖实验学校2022-2023学年高三上学期第三次月考化学试题广东省揭阳市惠来县第一中学2022-2023学年高二上学期期中考试化学试题第四章 非金属及其化合物 第19讲 卤素的性质及提取(已下线)题型46 从海水中提取氯、溴、碘广东省广州市越秀区2023-2024学年高二上学期开学考试化学试题河南省焦作第一中学2023-2024学年高三上学期9月化学模拟测试
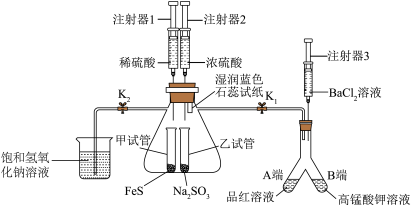
4 . 一体化实验装置能够快速制备物质并检验其性质,具有现象明显、无污染、操作方便等优点。二氧化硫和硫化氢的制备及性质检验一体化实验装置如图所示(夹持装置略去)。
①检查装置气密性。
②打开K2,关闭K1,注射器2将浓硫酸缓慢注入乙试管,观察湿润蓝色石蕊试纸颜色变化。
③关闭K2,打开K1,观察到Y型管A、B两端溶液均褪色。
④注射器3将BaCl2溶液缓慢注入Y型管B端,有白色沉淀生成。
⑤……
⑥用酒精灯微热Y型管A端,观察溶液的颜色变化。
回答下列问题:
(1)步骤②乙试管中发生反应的化学方程式为_______ 。
(2)能说明二氧化硫是酸性氧化物的实验现象为_______ 。
(3)步骤④产生白色沉淀的离子方程式为_______ 。
(4)步骤⑤说明二氧化硫具有氧化性,则该步骤的实验操作为_______ 。
(5)步骤⑥溶液的颜色变化为_______ 。
(6)饱和氢氧化钠溶液的作用是_______ 。
①检查装置气密性。
②打开K2,关闭K1,注射器2将浓硫酸缓慢注入乙试管,观察湿润蓝色石蕊试纸颜色变化。
③关闭K2,打开K1,观察到Y型管A、B两端溶液均褪色。
④注射器3将BaCl2溶液缓慢注入Y型管B端,有白色沉淀生成。
⑤……
⑥用酒精灯微热Y型管A端,观察溶液的颜色变化。
回答下列问题:
(1)步骤②乙试管中发生反应的化学方程式为
(2)能说明二氧化硫是酸性氧化物的实验现象为
(3)步骤④产生白色沉淀的离子方程式为
(4)步骤⑤说明二氧化硫具有氧化性,则该步骤的实验操作为
(5)步骤⑥溶液的颜色变化为
(6)饱和氢氧化钠溶液的作用是
您最近一年使用:0次
2023-01-12更新
|
349次组卷
|
4卷引用:章末检测卷(三) 物质的性质与转化
5 . 用下列装置不能达到有关实验目的的是
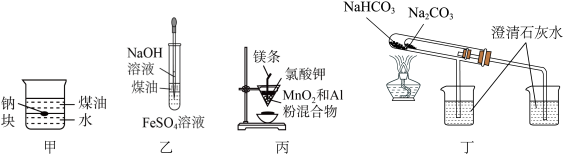

| A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水) |
| B.用乙图装置制备Fe(OH)2 |
| C.用丙图装置制取金属锰 |
| D.用丁图装置比较NaHCO3和Na2CO3的热稳定性 |
您最近一年使用:0次
2016-11-09更新
|
2126次组卷
|
26卷引用:人教版2017届高三单元精练检测三化学试题
人教版2017届高三单元精练检测三化学试题(已下线)2014届福建省福州市高三毕业班质检(第一次)理综化学试卷(已下线)2013-2014江西省南昌三中高二下学期期末考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2016届广东省东莞市六校高三上学期联考理综化学试卷12016届广东省东莞市六校高三上学期联考理综化学试卷22017届山东省济南一中高三上学期期中化学试卷苏教版2017届高三单元精练检测三化学试题苏教版2017届高三单元精练检测三化学试题陕西省黄陵中学高新部2018届高三上学期期中考试化学试题福建省莆田第六中学2017-2018学年高二6月月考化学试题A【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题湖北省武汉市汉阳一中2018-2019学年高一上学期12月月考化学试题(已下线)2019年8月11日《每日一题》2020年高考一轮复习—— 每周一测重庆市八中2018-2019学年高二下学期期末考试化学试题山西大学附中2020届高三上学期第二次模块诊断化学试题湖南省长沙市长沙县第六中学2020届高三上学期第二次月考化学试题内蒙古包头市包钢第四中学2018-2019学年高二下学期期末考试化学试题四川省宜宾市第四中学校2019-2020学年高二下学期第四学月考试化学试题福建省福州市第二中学2021届高三上学期第一次月考化学试题吉林省长春市第二十九中学2021届高三上学期第二学程考试化学试题(已下线)【浙江新东方】高中化学20210621-019【2021】【高一下】黑龙江省牡丹江市第十五中学2020-2021学年高二下学期期末考试化学试题甘肃省武威市第六中学2020届高三上学期第三次阶段性复习过关考试化学试题山东省济南市深泉外国语学校2022-2023学年高一上学期期末考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期开学测验化学试题
解题方法
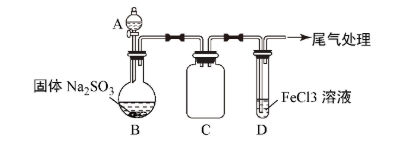
6 . 某校化学兴趣小组探究 与
与 溶液的反应,装置如下图所示。
溶液的反应,装置如下图所示。
已知:
ⅰ.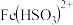 为红棕色,它可以将
为红棕色,它可以将 还原为
还原为 。
。
ⅱ.生成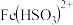 的反应为:
的反应为: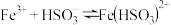 。
。
步骤一:实验准备
如上图连接装置,并配制100 mL 1.0mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D中。
(1)配制100 mL 1.0mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和___________ ,装置C的作用为___________ 。
步骤二:预测实验
(2)该小组同学预测 与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为___________ 。
步骤三:动手实验
(3)当将 通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
① 与FeCl3溶液反应生成了
与FeCl3溶液反应生成了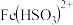 的实验证据为
的实验证据为___________ 。证明浅绿色溶液中含有 的实验操作为:
的实验操作为:___________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
综合上述实验探究过程,得出的结论为___________ 。
步骤四:反思实验
(4)在制备 的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是___________ 。
 与
与 溶液的反应,装置如下图所示。
溶液的反应,装置如下图所示。
已知:
ⅰ.
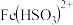 为红棕色,它可以将
为红棕色,它可以将 还原为
还原为 。
。ⅱ.生成
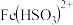 的反应为:
的反应为: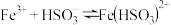 。
。步骤一:实验准备
如上图连接装置,并配制100 mL 1.0mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D中。
(1)配制100 mL 1.0mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
步骤二:预测实验
(2)该小组同学预测
 与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为
步骤三:动手实验
(3)当将
 通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。①
 与FeCl3溶液反应生成了
与FeCl3溶液反应生成了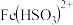 的实验证据为
的实验证据为 的实验操作为:
的实验操作为:②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
| 实验Ⅰ | 往5mL1mol·L-1 溶液中通入 溶液中通入 气体,溶液立即变为红棕色。微热3min,溶液颜色变为浅绿色。 气体,溶液立即变为红棕色。微热3min,溶液颜色变为浅绿色。 |
| 实验Ⅱ | 往5mL重新配制的1mol·L-1 溶液(用浓盐酸酸化)中通入 溶液(用浓盐酸酸化)中通入 气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
步骤四:反思实验
(4)在制备
 的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
您最近一年使用:0次
解题方法
7 . 氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系: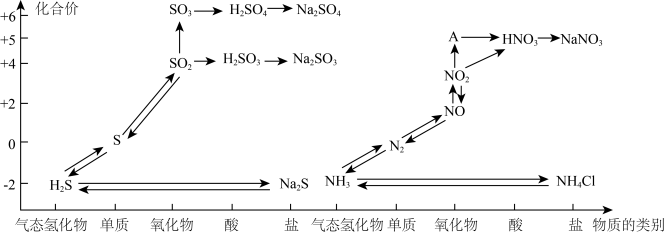
(1)根据A对应的化合价和物质类别,A为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________ ,反应的离子方程式为______________ 。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:_______________ 。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____ 。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为
您最近一年使用:0次
2020-05-29更新
|
723次组卷
|
2卷引用:第五章 化工生产中的重要非金属元素 单元测试
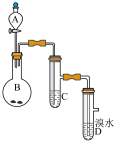
8 . 氨在人类的生产和生活中有着广泛的应用。利用下图装置某化学兴趣小组在实验室制备氨气并进行氨的催化氧化实验。
I制备并收集干燥的氨气

(1)A中反应的化学方程式为________ 。
(2)B装置的作用为_____ ,C装置用于收集氨气,则装置中导管的连接顺序为a→__ →__ →b。
(3)氨气的尾气处理装置不能 选用___ (填写代号)。

II氨的催化氧化实验
将铂丝烧至红热,放入盛有氨气和空气的锥形瓶中,请回答:
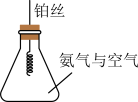
(4)氨的催化氧化反应的化学方程式为_______ 。
(5)锥形瓶内铂丝始终保持红热状态,说明该反应是___ 反应(填“吸热”或“放热”)。
(6)锥形瓶内的实验现象为_____ 。
I制备并收集干燥的氨气

(1)A中反应的化学方程式为
(2)B装置的作用为
(3)氨气的尾气处理装置

II氨的催化氧化实验
将铂丝烧至红热,放入盛有氨气和空气的锥形瓶中,请回答:

(4)氨的催化氧化反应的化学方程式为
(5)锥形瓶内铂丝始终保持红热状态,说明该反应是
(6)锥形瓶内的实验现象为
您最近一年使用:0次
2020-03-13更新
|
670次组卷
|
4卷引用:专题7 本专题达标检测-高中化学必修第二册苏教版2019
解题方法
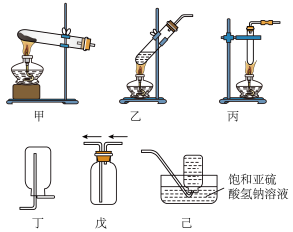
9 . (1)Cu与浓硫酸反应制备 的实验探究。
的实验探究。
①写出Cu与浓硫酸反应的化学方程式:___________________________
②如图所示,气体发生装置选取____________ (填“甲”“乙”或“丙”),气体收集装置选取_______________________________________ (填“丁”“戊”或“己”)。
(2)Zn与浓硫酸反应生成气体的实验探究。
结合实验室制备H2的反应,某实验小组猜想Zn与浓硫酸反应的气体生成物中含有H2杂质。该小组同学利用下列装置对Zn与浓硫酸反应生成的气体混合物进行实验探究:
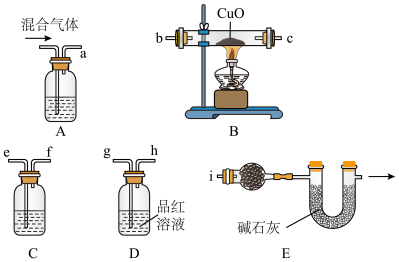
①装置的正确连接顺序为a→______________________________ 。
②装置A中盛有浓NaOH溶液,实验开始时,该装置中发生反应的离子方程式为______________________________ 。
③如果混合气体中含有足量的H2,则装置B中的现象是______________________________ 。
④装置C中盛装的试剂名称是______________________________ 。装置D的作用是______________________________ 。
⑤通过装置E的球形干燥管中盛有的试剂所产生的现象,可推断出Zn与浓硫酸反应生成的气体混合物中含有H2,该球形干燥管中盛装的试剂的化学式为______________________________ ,现象为______________________________ 。
 的实验探究。
的实验探究。①写出Cu与浓硫酸反应的化学方程式:
②如图所示,气体发生装置选取

(2)Zn与浓硫酸反应生成气体的实验探究。
结合实验室制备H2的反应,某实验小组猜想Zn与浓硫酸反应的气体生成物中含有H2杂质。该小组同学利用下列装置对Zn与浓硫酸反应生成的气体混合物进行实验探究:

①装置的正确连接顺序为a→
②装置A中盛有浓NaOH溶液,实验开始时,该装置中发生反应的离子方程式为
③如果混合气体中含有足量的H2,则装置B中的现象是
④装置C中盛装的试剂名称是
⑤通过装置E的球形干燥管中盛有的试剂所产生的现象,可推断出Zn与浓硫酸反应生成的气体混合物中含有H2,该球形干燥管中盛装的试剂的化学式为
您最近一年使用:0次
2020-04-09更新
|
356次组卷
|
2卷引用:第2章 化学键 化学反应与能量 综合拓展——B拓展区 夯实基础(鲁科版必修2)
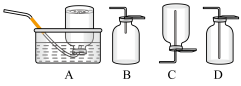
10 . 如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
(1)实验开始前,首先进行的操作是___ ;
(2)实验室制备乙炔的方程式为___ ;
(3)仪器A在安装前必须进行的操作是___ ,为防止气体生成的速率过快,由A滴入B的试剂为___ 。
(4)装置C可选用的试剂为___ (写出一种即可),其作用为___ ;
(5)反应开始后,D中的现象为___ ,所发生反应的反应类型为___ ;
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___ 。

(1)实验开始前,首先进行的操作是
(2)实验室制备乙炔的方程式为
(3)仪器A在安装前必须进行的操作是
(4)装置C可选用的试剂为
(5)反应开始后,D中的现象为
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是

您最近一年使用:0次
2019-11-13更新
|
865次组卷
|
4卷引用:第二章 烃
第二章 烃云南省云天化中学2019-2020学年高二上学期期中考试化学试题(已下线)2.2.2 炔烃-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题



