1 . 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜与稀硝酸反应的产物实验装置如图所示,气密性已检查。
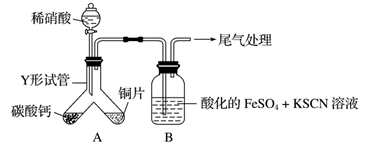
已知:FeSO4+NO===[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显
棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是___________________________________________________________ 。
(2)铜片和稀硝酸反应的化学方程式为____________________________________ 。
(3)本实验A生成的气体中,若有NO2,则B的实验现象为__________________ ;
若只有NO生成,则B的实验现象是_________________ 。
实验二 探究化学反应产物对反应速率的影响
设计如下实验,利用上图装置测定溶液突显明显棕色的时间。
(4)请将上表中实验1的实验条件填写完整。
①________ ,②________ ,③________ 。
(5)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是_______________________________________________________ 。
实验一 探究铜与稀硝酸反应的产物实验装置如图所示,气密性已检查。

已知:FeSO4+NO===[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显
棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
(2)铜片和稀硝酸反应的化学方程式为
(3)本实验A生成的气体中,若有NO2,则B的实验现象为
若只有NO生成,则B的实验现象是
实验二 探究化学反应产物对反应速率的影响
设计如下实验,利用上图装置测定溶液突显明显棕色的时间。
| 序号 | 温度 | 铜片/(g) | 硝酸/mL | 硝酸铜/g |
| 1 | 25 ℃ | ① | ② | ③ |
| 2 | 25 ℃ | 5 | 20 | 0.5 |
| 3 | 25 ℃ | 5 | 20 | 1.0 |
(4)请将上表中实验1的实验条件填写完整。
①
(5)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是
您最近一年使用:0次
2 . 为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。

请回答下列问题:
(1)装置A、D中发生反应的化学方程式为_____________________ ;_____________________ 。
(2)实验前欲检查装置A的气密性,可以采取的操作是___________________ ;
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是___________________ (用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为____________________________________ ;
(5)当D中产生__________________ 现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
(6)装置D的作用为________________________________ 。

请回答下列问题:
(1)装置A、D中发生反应的化学方程式为
(2)实验前欲检查装置A的气密性,可以采取的操作是
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为
(5)当D中产生
(6)装置D的作用为
您最近一年使用:0次
解题方法
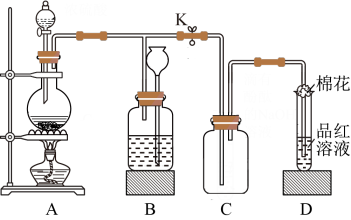
3 . 某化学课外兴趣小组用如图所示装置进行实验,制备某气体并验证其性质。请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②实验中,取一定质量的铜片和一定体积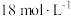 的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
A.有一定量的余酸但未能使铜片完全溶解,你认为原因是___________ 。
B.下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________ (填标号)。
a.铁粉 b. 溶液 c.银粉 d.
溶液 c.银粉 d. 溶液
溶液
(2)若装置A中分液漏斗盛装浓硫酸,圆底烧瓶盛装木炭。
①装置A中发生反应的化学方程式为___________ 。
②设计实验证明装置C中含有 时,所需的试剂有
时,所需的试剂有___________ (填标号)。
a. 溶液 b.澄清石灰水 c.品红溶液 d.酸性
溶液 b.澄清石灰水 c.品红溶液 d.酸性 溶液
溶液
(3)若装置A中分液漏斗盛装浓盐酸,圆底烧瓶盛装 粉末。
粉末。
①装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________ 。
②D中品红溶液褪色,加热试管里已褪色溶液时的现象为___________ 。
(4)装置D中试管口放置的棉花中浸了一种液体,可适用于(1)(2)(3)小题中实验,该液体是___________ 。
①装置A中发生反应的化学方程式为
②实验中,取一定质量的铜片和一定体积
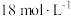 的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。A.有一定量的余酸但未能使铜片完全溶解,你认为原因是
B.下列药品中能用来证明反应结束后的烧瓶中确有余酸的是
a.铁粉 b.
 溶液 c.银粉 d.
溶液 c.银粉 d. 溶液
溶液(2)若装置A中分液漏斗盛装浓硫酸,圆底烧瓶盛装木炭。
①装置A中发生反应的化学方程式为
②设计实验证明装置C中含有
 时,所需的试剂有
时,所需的试剂有a.
 溶液 b.澄清石灰水 c.品红溶液 d.酸性
溶液 b.澄清石灰水 c.品红溶液 d.酸性 溶液
溶液(3)若装置A中分液漏斗盛装浓盐酸,圆底烧瓶盛装
 粉末。
粉末。①装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
②D中品红溶液褪色,加热试管里已褪色溶液时的现象为
(4)装置D中试管口放置的棉花中浸了一种液体,可适用于(1)(2)(3)小题中实验,该液体是
您最近一年使用:0次
2024-03-13更新
|
394次组卷
|
3卷引用:贵州省盘州市第七中学2023-2024学年高三上学期12月考试化学试卷
4 . 磷酸氢二铵[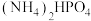 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备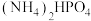 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。
(1)装置中活塞 的作用为
的作用为_______ 。实验过程中,当出现_______ 现象时,应及时关闭 ,打开
,打开 。
。
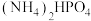 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备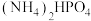 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。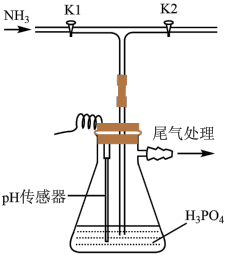
(1)装置中活塞
 的作用为
的作用为 ,打开
,打开 。
。
您最近一年使用:0次
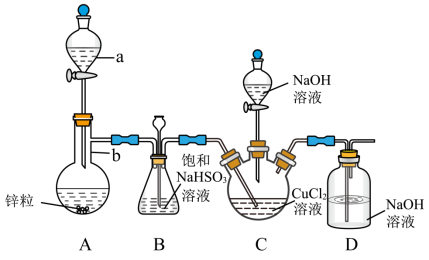
5 . CuCl是一种难溶于水和乙醇的白色固体,可溶于浓盐酸或者浓氨水(形成络合物),易被氧化为高价绿色铜盐,见光受热易分解。在催化领域广泛应用,纺织工业中常作脱色剂,可利用如图装置(夹持装置略去)将SO2通入新制氢氧化铜悬浊液中制备CuCl。
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)针对步骤2中的现象查阅资料得知:
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有 的操作方法是
的操作方法是_______ 。
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)针对步骤2中的现象查阅资料得知:
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有
 的操作方法是
的操作方法是
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
6 . 海洋蕴藏着中极为丰富的化学资源,如海水中就有80多种元素,所含的盐大部分是氯化钠。十九世纪末工业上开始通过电解饱和食盐水的方法制备氯气、氨气和烧碱,并以它们为原料生产一系列含氯、含钠产品(氯碱工业),请回答下列问题:
(1)天原化工厂是我国最早的氯碱企业,其创始人是___________(单选)
(2)电解饱和食盐水时,与电源正极相连的电极叫阳极,阳极产物是氯气,可以用___________ 检验,现象为___________ ,写出检验氯气的离子方程式___________
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为___________(单选)
(4)新制氯水呈浅黄绿色,是因为氯水中存在___________(单选)
(5)有两组学生根据不同的反应原理在实验室制取氯气。
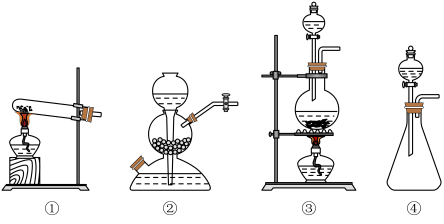
①请按要求填表。
②有同学建议第一组使用图所示装置作为氯气的发生装置,请谈谈你的看法___________ 。
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

(1)天原化工厂是我国最早的氯碱企业,其创始人是___________(单选)
| A.侯德榜 | B.吴蕴初 | C.荣毅仁 | D.戴安邦 |
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为___________(单选)
A. | B. | C. | D. |
A. | B. | C. | D. |

①请按要求填表。
| 实验组 | 实验原理 | 发生装置(填编号) |
| 第一组 |  | |
| 第二组 | 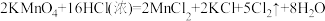 |

氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

您最近一年使用:0次
2023高三·全国·专题练习
解题方法
7 . 制备氮化镁的装置示意图如下:

请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象______________________ 。

请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象
您最近一年使用:0次
解题方法
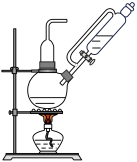
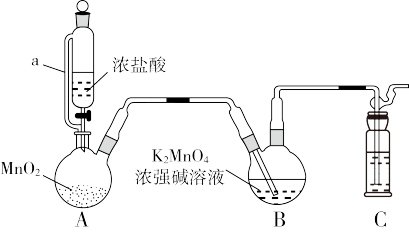
8 . 溶液常 用作氧化还原反应滴定的标准液,利用
用作氧化还原反应滴定的标准液,利用 氧化
氧化 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
已知: 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: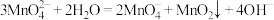
回答下列问题:
(1) 的化学名称为
的化学名称为_______ 。
(2)装置A中所发生反应的化学方程式为_______ ;其中a的作用是_______ 。
(3)装置C中盛装的试剂是_______ 。
(4)分析发现该装置有不足之处,改进的方法是_______ 。
(5)为测定某 固体的纯度,现用
固体的纯度,现用 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: )称取
)称取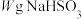 固体溶于水配成500mL溶液,取
固体溶于水配成500mL溶液,取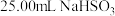 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。滴定终点的现象为
溶液V mL。滴定终点的现象为_______ , 固体的纯度为
固体的纯度为_______ 。
 用作氧化还原反应滴定的标准液,利用
用作氧化还原反应滴定的标准液,利用 氧化
氧化 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
已知:
 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: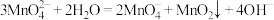
回答下列问题:
(1)
 的化学名称为
的化学名称为(2)装置A中所发生反应的化学方程式为
(3)装置C中盛装的试剂是
(4)分析发现该装置有不足之处,改进的方法是
(5)为测定某
 固体的纯度,现用
固体的纯度,现用 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: )称取
)称取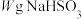 固体溶于水配成500mL溶液,取
固体溶于水配成500mL溶液,取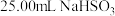 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。滴定终点的现象为
溶液V mL。滴定终点的现象为 固体的纯度为
固体的纯度为
您最近一年使用:0次
2022-11-15更新
|
169次组卷
|
2卷引用:江苏省淮安市高中校协作体2022-2023学年高三上学期期中考试化学试题
9 . 下面是有关钠及其化合物性质的探究实验。
(1)金属钠的密度比水___________ (填“大”或“小”),实验室中金属钠通常保存在中,取一小块金属钠投入水中,写出该反应的化学方程式___________ 。在实验过程中钠熔化成一个小球,根据这一现象你能得出的结论是:___________ 。
(2)将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是___________(填编号)。
(3)工业上以NaCl、NH3、CO2等为原料先制得NaHCO3,反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,进而生产纯碱。
某活动小组根据上述原理,制备碳酸氢钠。实验装置如图所示(夹持、固定用仪器未画出)。

乙装置中的试剂是______ ;实验中分离出NaHCO3晶体的操作是_______ (填分离操作名称)。
(1)金属钠的密度比水
(2)将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是___________(填编号)。
| A.有气体生成 | B.钠熔化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 | D.溶液变浑浊 |
某活动小组根据上述原理,制备碳酸氢钠。实验装置如图所示(夹持、固定用仪器未画出)。

乙装置中的试剂是
您最近一年使用:0次
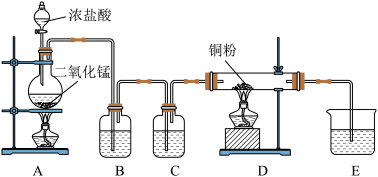
10 . (一)用 和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水
和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水 ,装置如下图所示。
,装置如下图所示。
回答下列问题:
(1)写出在A中发生反应的化学方程式为:_______________________________________________
(2)B中选用的试剂是______________ ,其作用是________________________ ;C中选用的试剂是______________ ,其作用是________________________ ;E中选用的试剂是_____________ ,其作用是________________________ ;
(3)D中反应的化学方程式是________________________________________________
(二)某校化学实验兴趣小组为了探究在实验室制备 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
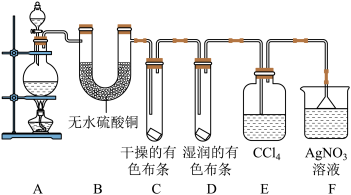
(4)若用含有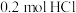 的浓盐酸与足量的
的浓盐酸与足量的 反应制
反应制 ,制得的
,制得的 体积(标准状况下)总是小于
体积(标准状况下)总是小于 的原因是
的原因是____________________________________________________ 。
(5)①装置B的作用是_______________________________________________ ,现象是_______________________________________________ 。
②装置C和D出现的不同现象说明的问题是_______________________________________________ 。
③装置E的作用是_______________________________________________ 。
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入 溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________ 与_________ 之间(填装置字母序号),装置中应放入____________________________________________ 。
 和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水
和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水 ,装置如下图所示。
,装置如下图所示。
回答下列问题:
(1)写出在A中发生反应的化学方程式为:
(2)B中选用的试剂是
(3)D中反应的化学方程式是
(二)某校化学实验兴趣小组为了探究在实验室制备
 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
(4)若用含有
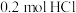 的浓盐酸与足量的
的浓盐酸与足量的 反应制
反应制 ,制得的
,制得的 体积(标准状况下)总是小于
体积(标准状况下)总是小于 的原因是
的原因是(5)①装置B的作用是
②装置C和D出现的不同现象说明的问题是
③装置E的作用是
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入
 溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
您最近一年使用:0次



