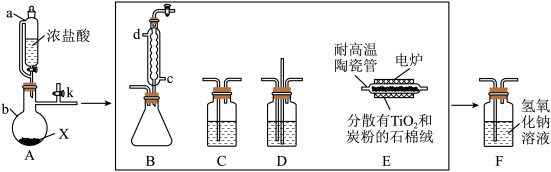
1 . TiCl4是制备金属钛的重要中间体,某兴趣小组利用如下装置在实验室制备TiCl4(夹持装置略),反应方程式为: 。
。
请回答:
(1)装置A中盛放浓盐酸的仪器a名称是_______ 。
(2)装置B中冷凝水进口是_______ (填“c”或“d”)。
(3)完善线框中装置排序_______ 。
A→D→_______→_______→_______→F
(4)仪器b中的固体X可以是_______ 。
A.MnO2 B.KMnO4 C.CaCl2
(5)下列说法正确的是_______。
(6)测定所得TiCl4的纯度:取1.000gTiCl4粗产品加入烧瓶,向安全漏斗中加入适量蒸馏水(装置如图),待充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴K2CrO4溶液做指示剂,用0.8000mol/LAgNO3溶液滴定至终点,消耗滴定液20.00mL。常温下,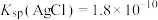 ,
,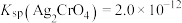 。
。_______ 。
②依据上述数据计算所得产品纯度是_______ 。
 。
。
| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
| TiCl4 | -25 | 136.4 | 高温时能与O2反应,与HCl不发生反应。易水解成白色沉淀,能溶于有机溶剂。 |
(1)装置A中盛放浓盐酸的仪器a名称是
(2)装置B中冷凝水进口是
(3)完善线框中装置排序
A→D→_______→_______→_______→F
(4)仪器b中的固体X可以是
A.MnO2 B.KMnO4 C.CaCl2
(5)下列说法正确的是_______。
| A.加热E装置前,应先进行装置A中反应或打开k通一段时间CO2 |
| B.装置D中长导管起平衡气压和判断装置是否通畅的作用 |
| C.装置D中盛有的试剂是饱和食盐水 |
| D.该实验中存在的缺陷是没有进行CO的尾气处理 |
(6)测定所得TiCl4的纯度:取1.000gTiCl4粗产品加入烧瓶,向安全漏斗中加入适量蒸馏水(装置如图),待充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴K2CrO4溶液做指示剂,用0.8000mol/LAgNO3溶液滴定至终点,消耗滴定液20.00mL。常温下,
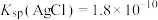 ,
,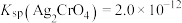 。
。
②依据上述数据计算所得产品纯度是
您最近一年使用:0次
2024-05-18更新
|
434次组卷
|
3卷引用:河北省重点高中2023-2024学年高三下学期5月高考模拟化学试题(二)
河北省重点高中2023-2024学年高三下学期5月高考模拟化学试题(二)(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)浙江省宁波市2024届高三下学期二模化学试题
2 . 用下列装置制取和收集气体正确的是(不考虑除杂和尾气吸收)
| 选项 | 制取气体 | a | b |
|
| A |  | 稀硫酸 | 大理石 | |
| B |  | 稀硝酸 | 铜粉 | |
| C |  | 浓硝酸 | 铝片 | |
| D |  | 双氧水 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 实验室用苯和液溴制取溴苯并验证其反应类型的实验装置图(夹持装置略)及有关数据如下,按下列步骤回答有关问题。
_______ 。
(2)在a中加入15mL无水苯和少量铁屑,在b中小心加入4mL液态溴,向a中滴入液溴,有白雾生成,a中发生反应的化学方程式为_______ 。
(3)d中CCl4的作用是_______ ;e中出现_______ ,则说明苯与液溴发生了取代反应。
(4)充分反应后,经过下列步骤分离提纯。
①反应后a瓶中的溴苯因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴依次用水、_______ 溶液、水洗涤。
②向分离出的粗溴苯中加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是_______ 。
③已知苯与溴还可能发生副反应生成对二溴苯(沸点 和邻二溴苯(沸点
和邻二溴苯(沸点 要进一步提纯,再进行
要进一步提纯,再进行_______ (填操作名称)即可得到较纯净的溴苯,该过程中为了受热均匀和易于控制温度,可采用_______ (填“水浴”或“油浴”)加热。
| 苯 | 溴 | 溴苯 | |
| 密度/(g·cm⁻³) | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解性 | 微溶 | 微溶 | 微溶 |

(2)在a中加入15mL无水苯和少量铁屑,在b中小心加入4mL液态溴,向a中滴入液溴,有白雾生成,a中发生反应的化学方程式为
(3)d中CCl4的作用是
(4)充分反应后,经过下列步骤分离提纯。
①反应后a瓶中的溴苯因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴依次用水、
②向分离出的粗溴苯中加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是
③已知苯与溴还可能发生副反应生成对二溴苯(沸点
 和邻二溴苯(沸点
和邻二溴苯(沸点 要进一步提纯,再进行
要进一步提纯,再进行
您最近一年使用:0次
4 . 阅读下列材料,按要求回答问题。
材料1 酒精、苯、CCl4都是有机溶剂,有机溶剂之间大多能互溶;
材料2 碘(I2)易溶于有机溶剂;
材料3 溴微溶于水,易溶于有机溶剂,其溶液呈橙红色。
在酒精、苯、CCl4、蒸馏水四种试剂中:
(1)能把碘单质从碘水中萃取出来的是___________ ,进行分液之后___________ (填“能”或“不能”)得到纯净的碘单质。
(2)能把溴从溴水中萃取出来,并在分液时使含溴液体从分液漏斗下口流出的是___________ 。
(3)CCl4___________ (填“能”或“不能”)把碘酒中的碘萃取出来,原因是___________ 。
材料1 酒精、苯、CCl4都是有机溶剂,有机溶剂之间大多能互溶;
材料2 碘(I2)易溶于有机溶剂;
材料3 溴微溶于水,易溶于有机溶剂,其溶液呈橙红色。
在酒精、苯、CCl4、蒸馏水四种试剂中:
(1)能把碘单质从碘水中萃取出来的是
(2)能把溴从溴水中萃取出来,并在分液时使含溴液体从分液漏斗下口流出的是
(3)CCl4
您最近一年使用:0次
2024·贵州黔西·一模
解题方法
5 . 硫及其化合物是十分重要的化工原料。
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):__________ (填字母)。
②已知开始时量气管读数为 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为__________  。
。
(2)已知 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。
①将 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为__________ 。
②将 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若__________ ,说明还原性: ,写出该反应的离子方程式:
,写出该反应的离子方程式:__________ 。
(3)为探究 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。
实验Ⅰ: ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。
①实验Ⅰ通入 时反应的离子方程式为
时反应的离子方程式为__________ ,实验Ⅱ通入 时反应的离子方程式为
时反应的离子方程式为__________ 。
②实验Ⅱ若消耗__________  ,则生成
,则生成 个
个 。
。
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):
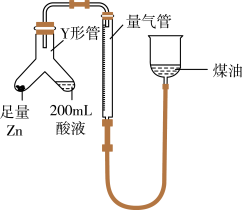
②已知开始时量气管读数为
 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为 。
。(2)已知
 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。①将
 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为②将
 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(3)为探究
 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。实验Ⅰ:
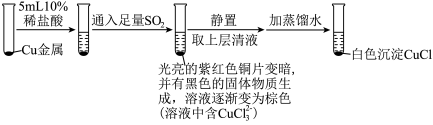
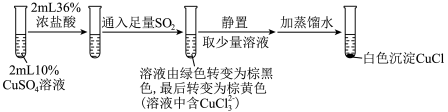
 ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。①实验Ⅰ通入
 时反应的离子方程式为
时反应的离子方程式为 时反应的离子方程式为
时反应的离子方程式为②实验Ⅱ若消耗
 ,则生成
,则生成 个
个 。
。
您最近一年使用:0次
6 . 由CuSO4溶液制取[Cu(NH3)4]SO4·H2O的实验如下:
步骤1:向盛有4mL0.1mol·L-1CuSO4溶液的试管中,滴加几滴1mol·L-1氨水,有蓝色沉淀生成。
步骤2:继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液。
步骤3:向试管中加入8mL95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法正确的是
步骤1:向盛有4mL0.1mol·L-1CuSO4溶液的试管中,滴加几滴1mol·L-1氨水,有蓝色沉淀生成。
步骤2:继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液。
步骤3:向试管中加入8mL95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法正确的是
| A.1mol[Cu(NH3)4]2+含有12mol共价键 |
| B.步骤2所发生反应的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- |
| C.步骤3中用玻璃棒摩擦试管壁是为了防止晶体析出时附着在试管壁上 |
| D.H2O与Cu2+的配位能力大于NH3 |
您最近一年使用:0次
2024高三·全国·专题练习
7 . 室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 用分液漏斗向盛有NaHCO3固体的锥形瓶中滴加乙酸溶液,将产生的气体通入盛有苯酚钠溶液的试管中,观察现象 | 碳酸与苯酚的酸性强弱 |
| B | 向蔗糖溶液中滴加稀硫酸,水浴加热,充分反应后冷却,加入NaOH溶液中和,再加入新制Cu(OH)2并加热,观察现象 | 蔗糖能否发生水解 |
| C | 加热溴乙烷与NaOH的乙醇溶液,将产生的气体直接通入酸性高锰酸钾溶液中,观察溶液颜色变化 | 乙醇是否发生了消去反应 |
| D | 向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,振荡后静置分液 | 提纯含有少量乙酸的乙酸乙酯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 氨气在工农业生产中有重要应用。
(1)工业合成氨的化学方程式为___________ 。
(2)某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。___________ 。
②用装置B收集氨时,进气口是___________ (选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是___________ ,___________ 。
③向C中NaOH固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为___________ ,检验白烟中阳离子的方法是:取少量白烟于试管中,___________ 。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有___________ 和4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(1)工业合成氨的化学方程式为
(2)某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。
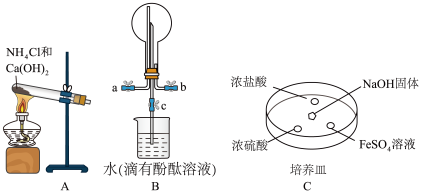
②用装置B收集氨时,进气口是
③向C中NaOH固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为
您最近一年使用:0次
2024-05-04更新
|
72次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期期中诊断化学试卷
2024高三·全国·专题练习
9 . 碱式氯化铜[Cu2(OH)2Cl2·3H2O]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
(1)模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。___________ (填名称)。
②反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是溶液中___________ 、干燥管b中___________ 。
③滴加过程中需要严格控制盐酸的用量,不能过多或过少的原因是___________ 。
④碱式氯化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40~50℃,向CuCl悬浊液中持续通空气制得。该反应的化学方程式为___________ 。
(2)采用沉淀滴定法测定某无水碱式氯化铜[Cux(OH)yClz]中的氯元素含量。称取产品6.435g,加稀硝酸溶解,并加水定容至250mL,得到待测液。请补充完整测定氯的实验过程:准确量取25.00mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010mol·L-1AgNO3溶液,至静置后向上层清液中继续滴加0.010mol·L-1AgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1mL(反应后有AgNO3剩余),___________ 。[须使用的实验试剂:0.010mol·L-1NH4SCN标准溶液、Fe(NO3)3溶液、聚乙烯醇]
已知:①Ag++SCN-=AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。
(1)模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
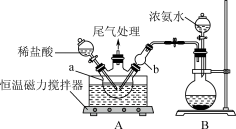
②反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是溶液中
③滴加过程中需要严格控制盐酸的用量,不能过多或过少的原因是
④碱式氯化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40~50℃,向CuCl悬浊液中持续通空气制得。该反应的化学方程式为
(2)采用沉淀滴定法测定某无水碱式氯化铜[Cux(OH)yClz]中的氯元素含量。称取产品6.435g,加稀硝酸溶解,并加水定容至250mL,得到待测液。请补充完整测定氯的实验过程:准确量取25.00mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010mol·L-1AgNO3溶液,至静置后向上层清液中继续滴加0.010mol·L-1AgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1mL(反应后有AgNO3剩余),
已知:①Ag++SCN-=AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
10 . 室温下,下列实验探究方案不能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向含酚酞的Na2CO3溶液中加入少量BaCl2固体,观察溶液颜色变化 | Na2CO3溶液中存在水解平衡 |
| B | 取久置Na2SO3粉末少许配成溶液,加入硝酸酸化,再加氯化钡溶液,观察现象 | 检验久置Na2SO3粉末变质 |
| C | 加热恒容密闭容器中NO2气体,观察气体颜色变化 | 2NO2(g) N2O4(g)是放热反应 N2O4(g)是放热反应 |
| D | 两支试管中分别盛相同温度、相同浓度、相同体积的H2O2溶液,分别滴加相同浓度、相同体积的FeCl3溶液与CuCl2溶液,滴加FeCl3溶液的试管中产生气体更快 | FeCl3对H2O2分解的催化效率更高 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次




