1 . 固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是______ 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
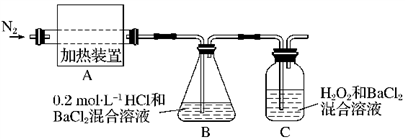
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明______ 。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是______ ;关闭k,用酒精灯加热时,正确操作是先______ ,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______ 是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______ (填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是______ 。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
您最近一年使用:0次
2 . 硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO 3、H2O、N2和
3、H2O、N2和__________ 。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是__________________________ 。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________ (填字母)。
A.KSCN溶液B.稀硫酸
C.浓盐 酸D.KMnO4溶液
酸D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________ 气体生成,若含有该气体,观察到的现象为_______________________________________ 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________ (填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________ (用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________ ;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________ 。
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO
 3、H2O、N2和
3、H2O、N2和(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是
②为验证A中残留物是否含有FeO,需要选用的试剂有
A.KSCN溶液B.稀硫酸
C.浓盐
 酸D.KMnO4溶液
酸D.KMnO4溶液③装置B中BaCl2溶液的作用是为了检验分解产物中是否有
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO
 +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为
您最近一年使用:0次
2016-12-09更新
|
952次组卷
|
6卷引用:浙江省2018版考前特训(2017年10月)加试30分特训:6 化学实验的测定、设计及评价
3 . 将绿矾(FeSO4•7H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
【实验一】为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
【实验二】为进一步探究该反应的产物,进行了如下图所示的实验:
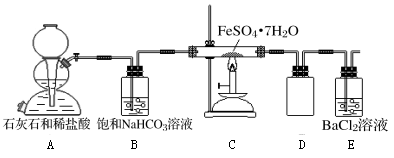
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________ 。
(2)饱和NaHCO3的作用是______ ,其水溶液呈碱性的原因(用离子方程式解释)____________ 。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________ 。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________ 。
【实验一】为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
| 猜想 | 实验操作 | 预期现象 |
| 猜想一:铁元素只显 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色 |
| 猜想二:铁元素只显 | 加入KSCN溶液呈 | |
| 猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
【实验二】为进一步探究该反应的产物,进行了如下图所示的实验:

(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是
(2)饱和NaHCO3的作用是
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为
(4)该组同学设计的装置存在着一个明显的缺陷是
您最近一年使用:0次
2016-12-09更新
|
374次组卷
|
2卷引用:专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升
解题方法
4 . 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
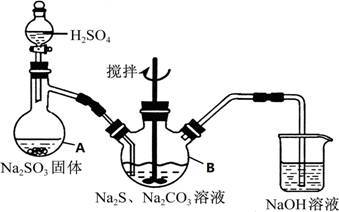
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称_____________ ,步骤④中洗涤时,为了减少产物的损失的试剂可以是_______
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因_____________
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论_____________
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol•L﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为_______ mL,产品的纯度为_______ %
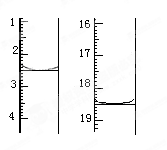
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果________ (填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为________ 。

实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol•L﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为

②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为
您最近一年使用:0次
2016-12-09更新
|
251次组卷
|
3卷引用:2020届高三化学二轮每周大题必练— —— 无机物制备实验流程
5 . 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
甲:Fe2O3、NO2乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2丁:FeO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是__________________ .
针对上述猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,应______________
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,___________ ,后再关闭K,用酒精灯加热
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加入适量水,未见明显现象.
(3)实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有____________ 。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检测到的原因是_________________ 。
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式______________ ,通入O2的物质的量为_____________ 。
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。写一点不足之处:__________________________ 。
甲:Fe2O3、NO2乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2丁:FeO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是
针对上述猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,应
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加入适量水,未见明显现象.
(3)实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检测到的原因是
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。写一点不足之处:
您最近一年使用:0次
6 . 化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
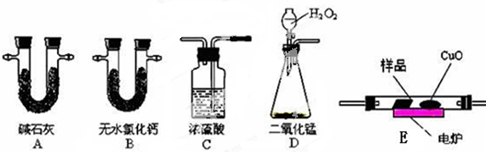
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________ (每种装置只用一次);
(2)实验数据记录和处理
上表中①、②分别指哪个装置?____________ 、 _____________ 。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________ ;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________ ,与该有机物相对分子质量相同的烃的一氯代物有_____ 种。

实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:
(2)实验数据记录和处理
| 物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
| 实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
| 1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式
您最近一年使用:0次
2016-12-09更新
|
643次组卷
|
3卷引用:三轮冲刺2020届高三化学考题必刷——物质含量定量探究分析题
7 . 部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法正确的是

下列说法正确的是
| A.V=44.8 |
| B.原样品中铁元素的质量分数约为38.89% |
| C.滤液A中的阳离子为Fe2+、Fe3+、H+ |
| D.样品中CuO的质量为4.0 g |
您最近一年使用:0次
2016-05-04更新
|
334次组卷
|
4卷引用:2019年1月20日 《每日一题》 高考二轮复习-每周一测
(已下线)2019年1月20日 《每日一题》 高考二轮复习-每周一测2016届内蒙古赤峰市宁城县高三下学期第三次统一模拟考试化学试卷2017届辽宁省东北育才学校高三上学期第一次模拟化学试卷2017届辽宁省沈阳东北育才学校高三上模拟一化学试卷



