2022高三·全国·专题练习
解题方法
1 . 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3,质量为1.02g。计算:x=_______ (写出计算过程)。
您最近一年使用:0次
2 . 草酸、KMnO4均是重要的化学分析试剂,某次实验中需要使用480mL0.2000mol/L的草酸溶液,回答下列问题。
(1)实验中需要称取___________ g草酸晶体(H2C2O4•2H2O),称量后___________ (填“需要”或“不需要”)加热除去相应的结晶水;配制过程中需要使用的玻璃仪器有玻璃棒、胶头滴管及___________ 。
(2)假设称取草酸时使用的是托盘天平,称量中试剂与砝码位置错放,则所配制溶液中c(H2C2O4)0.2000
___________ (填“>”、“=”或“<”,下同);若定容时俯视刻度线,则所配溶液中c(H2C2O4)___________ 0.2000 。
。
(3)若配置溶液时所取草酸晶体不纯(杂质无还原性),为测定草酸的纯度,某同学量取20.00mL,上述所配溶液放入锥形瓶中,然后用0.1000 的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
①标准溶液应使用___________ (填“酸”或“碱”)式滴定管取用,合理的V值可能是___________ 。
A. 15.8 B. 16.20 C. 15.82 D. 16.18
②滴定终点时溶液颜色的变化为___________ ,样品中草酸晶体的质量分数为___________ (用含V的式子表示)。
(1)实验中需要称取
(2)假设称取草酸时使用的是托盘天平,称量中试剂与砝码位置错放,则所配制溶液中c(H2C2O4)0.2000

 。
。(3)若配置溶液时所取草酸晶体不纯(杂质无还原性),为测定草酸的纯度,某同学量取20.00mL,上述所配溶液放入锥形瓶中,然后用0.1000
 的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。①标准溶液应使用
A. 15.8 B. 16.20 C. 15.82 D. 16.18
②滴定终点时溶液颜色的变化为
您最近一年使用:0次
3 . 镀镍废水是重金属污染源之一,常见处理含镍废水的一种离子交换和沉淀法工艺如下:
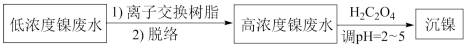
已知该交换树脂为阳离子型树脂HR,HR R-+H+;NiR2(aq)
R-+H+;NiR2(aq) Ni2+(aq)+2R-(aq)。
Ni2+(aq)+2R-(aq)。
(1)Ni2+的核外电子排布式为___________ 。
(2)已知在pH=2时,离子交换过程Ni2+去除率很低,其原因为_______ 。
(3)“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R-与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。反应的方程式如下:
Ⅰ.Fe2++H2O2=Fe3++OH-+·OH
Ⅱ.R-+·OH=OH-+·R
平衡移动的角度解释加入FeSO4和H2O2能够实现“脱络”的原因是___________ 。
(4)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为___________ 。
(5)硫酸镍铵(NH4)xNiy(SO4)m·nH2O可用于电镀等领域,为测定其组成,进行如下实验:
①称取4.670样品,配成250mL溶液A。
②取25.00mL溶液A,加足量浓NaOH溶液并加热,生成NH3 44.80mL (标准状况)。
③另取25.00mL溶液A,用0.05000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),平行测定三次,平均消耗标准EDTA溶液20.00mL。
则硫酸镍铵的化学式为___________ (写出计算过程)。

已知该交换树脂为阳离子型树脂HR,HR
 R-+H+;NiR2(aq)
R-+H+;NiR2(aq) Ni2+(aq)+2R-(aq)。
Ni2+(aq)+2R-(aq)。(1)Ni2+的核外电子排布式为
(2)已知在pH=2时,离子交换过程Ni2+去除率很低,其原因为
(3)“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R-与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。反应的方程式如下:
Ⅰ.Fe2++H2O2=Fe3++OH-+·OH
Ⅱ.R-+·OH=OH-+·R
平衡移动的角度解释加入FeSO4和H2O2能够实现“脱络”的原因是
(4)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为
(5)硫酸镍铵(NH4)xNiy(SO4)m·nH2O可用于电镀等领域,为测定其组成,进行如下实验:
①称取4.670样品,配成250mL溶液A。
②取25.00mL溶液A,加足量浓NaOH溶液并加热,生成NH3 44.80mL (标准状况)。
③另取25.00mL溶液A,用0.05000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),平行测定三次,平均消耗标准EDTA溶液20.00mL。
则硫酸镍铵的化学式为
您最近一年使用:0次
名校
解题方法
4 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
791次组卷
|
10卷引用:山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题
山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷山东省济南市商河县第三中学2022届高三10月月考化学试题2021年河北省高考化学试卷变式题10-18题广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)河南省顶级名校2023届高三上学期10月月考化学试题(已下线)第1讲 钠及其重要化合物
名校
5 . 硫酸铜晶体受热脱水是分步进行的。现取1.60gCuSO4·5H2O样品,在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。
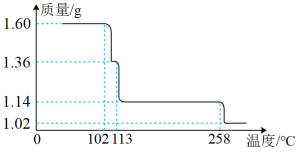
请回答下列问题:
(1)试确定200℃时:①固体物质的化学式________________ ;
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉未和一种氧化性气体,该反应的化学方程式为___________ 。把该黑色粉未溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________ ,其存在的最高温度是_________ ;
(3)上述氧化性气体与水反应生成一种化合物,使用单线桥法表示该化合物的浓溶液与Cu在加热时发生反应的电子转移为__________ 。

请回答下列问题:
(1)试确定200℃时:①固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉未和一种氧化性气体,该反应的化学方程式为
(3)上述氧化性气体与水反应生成一种化合物,使用单线桥法表示该化合物的浓溶液与Cu在加热时发生反应的电子转移为
您最近一年使用:0次
名校
解题方法
6 . 二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________ 。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓)
 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O2SO2+SeO2+2H2O
 Se+2SO42-+4H+
Se+2SO42-+4H+SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3
 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为_________________ 。
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为_______________ 。
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1) 可循环使用的物质是______ 。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为__________________ 。
(2) 检验CaO2·8H2O是否洗净的操作是________ 。
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)__________ 。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4
 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3(1)除去固体产物中Al2O3的离子方程式为
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1) 可循环使用的物质是
(2) 检验CaO2·8H2O是否洗净的操作是
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)
您最近一年使用:0次
名校
8 . 5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。

请回答下列问题:
(1)试确定110℃时固体物质的化学式_____________________ ;
(2)取200℃所得样品,加热至280oC, 该反应的化学方程式为:_______________ ;
(3)将280oC所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为______________ 。
(4)把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体其存在的最高温度是______ ;
(5)天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为amol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡________ 。

请回答下列问题:
(1)试确定110℃时固体物质的化学式
(2)取200℃所得样品,加热至280oC, 该反应的化学方程式为:
(3)将280oC所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为
(4)把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体其存在的最高温度是
(5)天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为amol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡
您最近一年使用:0次
名校
9 . 某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、酸性KMnO4溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式_______________________________________ 。
(2)试设计实验证明溶液X中含过氧化氢____________________________________ 。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:______ H2O2+______ Fe2++_____ OH-===______ Fe(OH)3↓,该反应中H2O2表现了_______ (填“氧化”或“还原”)性。
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了______ (填“氧化”或“还原”)性。该反应的离子方程式为____________________ 。
(1)写出Na2O2与水反应的化学方程式
(2)试设计实验证明溶液X中含过氧化氢
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了
您最近一年使用:0次
名校
10 . 钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3 等物质)。

已知:物质溶解性:LiF难溶于水,Li2CO3微溶于水
请回答:
(1)Ⅰ中发生反应的化学方程式为______________________ 。如是氧化还原反应,在方程式中用单线桥标记电子转移:_________________________ 。如不是此步略。
(2)写出步骤Ⅰ中Co2O3 与盐酸反应生成Cl2的离子方程式:_____________________ 。
(3)废渣中的主要成分除了LiF外,还有____________________ 。
(4) NaF与溶液中的Li+形成LiF 沉淀,此反应对步骤Ⅳ所起的作用是___________________ 。
(5)在空气中加热10.98g 草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4·2H2O)= 183g/mol。
经测定,加热到210℃时,固体物质的化学式为__________________ 。加热到210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________________________ 。温度高于890℃时,固体产物发生分解反应,固体产物为________________ 。

已知:物质溶解性:LiF难溶于水,Li2CO3微溶于水
请回答:
(1)Ⅰ中发生反应的化学方程式为
(2)写出步骤Ⅰ中Co2O3 与盐酸反应生成Cl2的离子方程式:
(3)废渣中的主要成分除了LiF外,还有
(4) NaF与溶液中的Li+形成LiF 沉淀,此反应对步骤Ⅳ所起的作用是
(5)在空气中加热10.98g 草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4·2H2O)= 183g/mol。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 290~320 | 4. 82 |
| 890~920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为
您最近一年使用:0次



