解题方法
1 . 在“价-类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,f、g均为含钠元素的正盐,请回答:
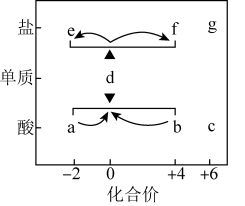
(1)当a与b混合时,可观察到的现象是___________ ;
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为___________ ;
(3)某同学利用下列装置测定空气中 的含量。
的含量。
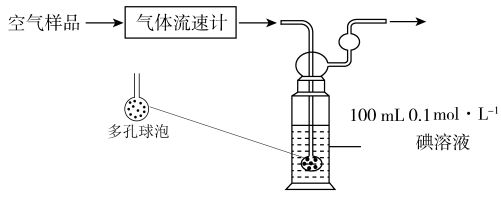
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是___________ ,该装置中 与碘
与碘 溶液发生反应的化学方程式为:
溶液发生反应的化学方程式为:___________ 。若空气流速为 ,当
,当 与碘
与碘 溶液恰好完全反应时,耗时10min,则该空气样品中
溶液恰好完全反应时,耗时10min,则该空气样品中 的含量是
的含量是___________  。(用含V的最简表达式表示)
。(用含V的最简表达式表示)

(1)当a与b混合时,可观察到的现象是
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为
(3)某同学利用下列装置测定空气中
 的含量。
的含量。
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是
 与碘
与碘 溶液发生反应的化学方程式为:
溶液发生反应的化学方程式为: ,当
,当 与碘
与碘 溶液恰好完全反应时,耗时10min,则该空气样品中
溶液恰好完全反应时,耗时10min,则该空气样品中 的含量是
的含量是 。(用含V的最简表达式表示)
。(用含V的最简表达式表示)
您最近一年使用:0次
2023-04-21更新
|
178次组卷
|
2卷引用:浙江省杭州市六县九校联考2022-2023学年高一下学期4月期中考试化学试题
2023高三·全国·专题练习
2 . 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g。则样品中氨基甲酸铵的物质的量分数为_______ 。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
您最近一年使用:0次
21-22高一·全国·假期作业
3 . Na2O2是一种重要化工原料,工业上可以用来漂白纺织类物品、麦秆、纤维等。回答下列问题:
(1)Na2O2中氧元素化合价为_______ ,写出过氧化钠与水反应的化学方程式_______ 。
(2)过氧化钠若长期保存不当,容易生成_______ (填化学式),证明过氧化钠变质情况的一种实验方案如下。
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下_______ m3空气(只需列出计算表达式,已知氧气占空气体积分数约为20%,空气的密度为1.293g/cm3)。
(1)Na2O2中氧元素化合价为
(2)过氧化钠若长期保存不当,容易生成
| 操作 | 现象 | 结论 |
| 取少量样品于试管中,加水溶解,加入 | 有白色沉淀生成 | |
| 另取少量样品于试管中,再加入适量的水,用带火星的木条靠近管口 | 带火星的木条复燃 |
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下
您最近一年使用:0次
名校
解题方法
4 . 某 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
(1)样品中物质的量之比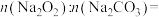
_______ 。
(2)盐酸的物质的量浓度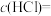
_______ 。
(3)实验Ⅲ完全反应后的溶液中,溶质除NaCl外其他组分的化学式及物质的量分别为_______ 。
 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积/ | 100.0 | 100.0 | 100.0 | 100.0 |
| 样品质量/g | 2.62 | 3.93 | 5.24 | 6.55 |
气体总体积/ | 448 | 560 | 448 | 560 |
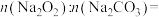
(2)盐酸的物质的量浓度
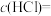
(3)实验Ⅲ完全反应后的溶液中,溶质除NaCl外其他组分的化学式及物质的量分别为
您最近一年使用:0次
5 . 矾是一类含硫化合物,一般都含有氢、氧、硫等元素,在生活和生产中有着重要应用。
(1)硫元素在周期表中的位置是___________ ,与硫原子占有相同轨道数目的阳离子有___________ (用微粒符号表示)。
(2)从原子结构的角度解释硫元素的非金属性比氧弱的原因:___________ 。
(3)蓝矾(CuSO4•5H2O)常用于冶金、制农药等。实验室常用蓝矾溶液检验H2S气体,该反应的离子方程式为___________ 。
(4)绿矾(FeSO4•7H2O)水溶液显酸性,在空气中久置出现红褐色的Fe(OH)3沉淀,且溶液的酸性增强,该反应的离子方程式为___________ 。因此绿矾水溶液保存时防止变质可加入试剂为___________ (填化学式)。
(5)已知黄矾[FexS2O9•yH2O]中Fe、S的化合价分别为+3、+6,则x=___________ 。将2.500g样品加热到110℃时,样品失掉部分结晶水,恒重后的固体质量为2.320g;将样品继续高温加热至恒重,得到氧化铁0.800g。黄矾的化学式为___________ 。
(1)硫元素在周期表中的位置是
(2)从原子结构的角度解释硫元素的非金属性比氧弱的原因:
(3)蓝矾(CuSO4•5H2O)常用于冶金、制农药等。实验室常用蓝矾溶液检验H2S气体,该反应的离子方程式为
(4)绿矾(FeSO4•7H2O)水溶液显酸性,在空气中久置出现红褐色的Fe(OH)3沉淀,且溶液的酸性增强,该反应的离子方程式为
(5)已知黄矾[FexS2O9•yH2O]中Fe、S的化合价分别为+3、+6,则x=
您最近一年使用:0次
6 . 铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(1)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是_______ (用离子方程式表示)。
(2)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液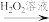 溶液I
溶液I  沉淀II
沉淀II 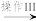 Fe2O3
Fe2O3
①H2O2溶液的作用是_______ 。
②“溶液I”的溶质为_______ (填化学式),写 出由“溶液I”到“沉淀II”反应的离子方程式:_______ 。
③“操作III”的名称为_______ 。
(3)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:_______ (填标号);重复上述操作步骤,直至装置A恒重,记为m3 g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=_______ (列出计算式即可)。
(1)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是
(2)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液
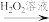 溶液I
溶液I  沉淀II
沉淀II 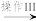 Fe2O3
Fe2O3①H2O2溶液的作用是
②“溶液I”的溶质为
③“操作III”的名称为
(3)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g。按图示连接好装置进行实验。

①将下列实验操作步骤正确排序:
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量装置A
f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=
您最近一年使用:0次
解题方法
7 . 亚氯酸钠( )是一种重要的含氯消毒剂。电解法生产
)是一种重要的含氯消毒剂。电解法生产 的部分工艺流程如下:
的部分工艺流程如下:

(1)饱和 溶液由粗盐水精制而成,为除去粗盐水中的
溶液由粗盐水精制而成,为除去粗盐水中的 和
和 ,需加入的试剂分别为
,需加入的试剂分别为_ 、_ 。
(2)写出“无隔膜电解”步骤发生反应的化学方程式____ 。
(3) 在溶液中可生成
在溶液中可生成 、
、 、
、 等微粒,其中
等微粒,其中 和
和 都具有漂白作用,但
都具有漂白作用,但 是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是___________________ (填字母)
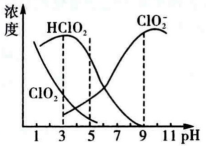
A. 在碱性条件下较稳定
在碱性条件下较稳定
B. 25℃时,该溶液在pH=4时比pH=11时更适合漂白
C.pH=7时,溶液中含氯微粒浓度大小为:c( )>c(
)>c( )>e(
)>e( )>c(
)>c( )
)
(4) 可发生反应3
可发生反应3 =2
=2 +
+ 而变质。
而变质。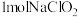 完全变质,理论上转移电子
完全变质,理论上转移电子_ mol。
(5)通过下列实验可测定所得 产品的纯度,实验检测原理为:
产品的纯度,实验检测原理为: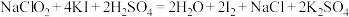 ;
;
①取1.000g样品,用适量蒸馏水溶解后,加入略过量的 溶液;
溶液;
②充分反应后,将反应液定容至200.00mL;
③取出20.00mL于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液,用0.2000mol∙L-1的溶液 与之反应,至恰好完全反应时消耗
与之反应,至恰好完全反应时消耗 溶液22.00mL。
溶液22.00mL。
计算该样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)__________ 。
 )是一种重要的含氯消毒剂。电解法生产
)是一种重要的含氯消毒剂。电解法生产 的部分工艺流程如下:
的部分工艺流程如下:
(1)饱和
 溶液由粗盐水精制而成,为除去粗盐水中的
溶液由粗盐水精制而成,为除去粗盐水中的 和
和 ,需加入的试剂分别为
,需加入的试剂分别为(2)写出“无隔膜电解”步骤发生反应的化学方程式
(3)
 在溶液中可生成
在溶液中可生成 、
、 、
、 等微粒,其中
等微粒,其中 和
和 都具有漂白作用,但
都具有漂白作用,但 是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
A.
 在碱性条件下较稳定
在碱性条件下较稳定B. 25℃时,该溶液在pH=4时比pH=11时更适合漂白
C.pH=7时,溶液中含氯微粒浓度大小为:c(
 )>c(
)>c( )>e(
)>e( )>c(
)>c( )
)(4)
 可发生反应3
可发生反应3 =2
=2 +
+ 而变质。
而变质。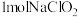 完全变质,理论上转移电子
完全变质,理论上转移电子(5)通过下列实验可测定所得
 产品的纯度,实验检测原理为:
产品的纯度,实验检测原理为: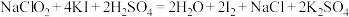 ;
;
①取1.000g样品,用适量蒸馏水溶解后,加入略过量的
 溶液;
溶液;②充分反应后,将反应液定容至200.00mL;
③取出20.00mL于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液,用0.2000mol∙L-1的溶液
 与之反应,至恰好完全反应时消耗
与之反应,至恰好完全反应时消耗 溶液22.00mL。
溶液22.00mL。计算该样品中
 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
名校
8 . 氢氧化钙长期存放容易变质。某科学探究小组在实验时取了一瓶存放多年的氢氧化钙来检验其变质情况。首先取氢氧化钙样品12.2g于锥形瓶中,加入32.8g水,充分振荡形成悬浊液,然后向锥形瓶中逐滴滴加29.2%的盐酸使其充分反应。实验测得加入盐酸的质量与锥形瓶中物质的质量的关系如图所示:
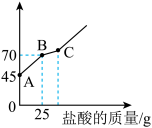
求:
(1)图中AB段与盐酸反应的物质是_____ 。
(2)图中BC段发生反应的化学方程式为_____ 。
(3)样品中氢氧化钙的质量分数_____ (精确到0.1,写出计算步骤)。

求:
(1)图中AB段与盐酸反应的物质是
(2)图中BC段发生反应的化学方程式为
(3)样品中氢氧化钙的质量分数
您最近一年使用:0次
名校
9 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
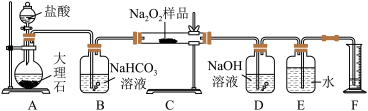
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
551次组卷
|
5卷引用:人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验
人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
解题方法
10 . (1)0.3molNH3分子中所含原子数与___________ 个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________ (填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________ 。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________ ,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________ 。
A.Cl- B.NO3- C.CO32- D.OH-
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)
A.Cl- B.NO3- C.CO32- D.OH-
您最近一年使用:0次



