1 . 镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为______________________ 。
(2)MgO可溶于NH4Cl溶液的化学方程式为______________________ 。
II.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下: ①在NH4Cl溶液中加入Ca(OH)2 ②不断搅拌的同时加入30% H2O2(弱酸性),生成CaO2•8H2O沉淀 ③经过陈化、过滤、水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
(1)CaO2的电子式为____________ 。
(2)可循环使用的物质是________ 。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为_____________________________ 。
(3)检验CaO2•8H2O是否洗净的操作是____________________ 。
(4)测定产品中CaO2含量:
取mg样品,与足量稀硫酸反应充分,生成的H2O2用cmol/L的KMnO4溶液滴定,消耗标准液的体积为VmL,则该样品中CaO2质量百分数为(含m、C、V的表达式)_________________ 。
I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4
 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3 (1)除去固体产物中Al2O3的离子方程式为
(2)MgO可溶于NH4Cl溶液的化学方程式为
II.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下: ①在NH4Cl溶液中加入Ca(OH)2 ②不断搅拌的同时加入30% H2O2(弱酸性),生成CaO2•8H2O沉淀 ③经过陈化、过滤、水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
(1)CaO2的电子式为
(2)可循环使用的物质是
(3)检验CaO2•8H2O是否洗净的操作是
(4)测定产品中CaO2含量:
取mg样品,与足量稀硫酸反应充分,生成的H2O2用cmol/L的KMnO4溶液滴定,消耗标准液的体积为VmL,则该样品中CaO2质量百分数为(含m、C、V的表达式)
您最近一年使用:0次
2 . 某学习小组查阅资料加。大多数硝酸盐不稳定。受热易分解,分解产物与金属活动顺序有关)了探究硝酸铁分解产物。他们进行如下探究:
(一)探究气体产物
[提出假设]
他们对气体产物提出如下猜想:
猜想1:气体为NO2
猜想2:气体为NO和O2
猜想3:气体为NO和NO2
清想4:气体为NO2和O2
猜想5:气体为NO
(1)他们经过讨论,认为猜想2不成立。理由是_______ ;根据氧化还原反应原理,不成立的猜想还有__________
[查阅资料]
①几种气体熔点。沸点如下:
②2NO2(g) N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0
[设计实验]
加热装置省略(冰盐冷却剂温度约为-5℃)

取一定量无水硝酸铁粉术进行实验,实验结果: A中U形管收集到少量液体物质;B中排水法收集一部分气体
(2)本实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是___________
(3)实验完毕,取出U形管,打开塞子。观察到有棕色气体产生,则U形管内的气体是_____
向U形管加入_____ 能吸收该物质。避免污染环境。
(4)检验B瓶收集气体为氧气的操作方法是__________
(二)探究固体成分
分析固体中铁元素价态,可能有种情况:①+2价②+3价③+2价和+3价。
为了探究固体中铁元素价态。甲、乙同学设计如下方案:
(5)上述实验,不能确定固体成分的实验是______ (填“甲”或“乙”);根据上迷实验结论。写出硝酸铁分解反应的化学方程式______________
(一)探究气体产物
[提出假设]
他们对气体产物提出如下猜想:
猜想1:气体为NO2
猜想2:气体为NO和O2
猜想3:气体为NO和NO2
清想4:气体为NO2和O2
猜想5:气体为NO
(1)他们经过讨论,认为猜想2不成立。理由是
[查阅资料]
①几种气体熔点。沸点如下:
| 气体 | NO | NO2 | O2 |
| 熔点/℃ | -163.6 | -11.2 | |
| 沸点/℃ | -151 | 21.1 | -183 |
②2NO2(g)
 N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0[设计实验]
加热装置省略(冰盐冷却剂温度约为-5℃)

取一定量无水硝酸铁粉术进行实验,实验结果: A中U形管收集到少量液体物质;B中排水法收集一部分气体
(2)本实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是
(3)实验完毕,取出U形管,打开塞子。观察到有棕色气体产生,则U形管内的气体是
向U形管加入
(4)检验B瓶收集气体为氧气的操作方法是
(二)探究固体成分
分析固体中铁元素价态,可能有种情况:①+2价②+3价③+2价和+3价。
为了探究固体中铁元素价态。甲、乙同学设计如下方案:
| 步骤 | 现象 | |
| 甲 | 取少量样品于试管,加入适量稀硫酸使固体完全溶解,再滴加酸性高锰酸钾溶液 | 溶液无明显颜色变化 |
| 乙 | 取少量样品于试管,加入稀盐酸使固体完全溶解,滴加KSCN溶液 | 溶液变红色 |
(5)上述实验,不能确定固体成分的实验是
您最近一年使用:0次
名校
3 . 钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3 等物质)。

已知:物质溶解性:LiF难溶于水,Li2CO3微溶于水
请回答:
(1)Ⅰ中发生反应的化学方程式为______________________ 。如是氧化还原反应,在方程式中用单线桥标记电子转移:_________________________ 。如不是此步略。
(2)写出步骤Ⅰ中Co2O3 与盐酸反应生成Cl2的离子方程式:_____________________ 。
(3)废渣中的主要成分除了LiF外,还有____________________ 。
(4) NaF与溶液中的Li+形成LiF 沉淀,此反应对步骤Ⅳ所起的作用是___________________ 。
(5)在空气中加热10.98g 草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4·2H2O)= 183g/mol。
经测定,加热到210℃时,固体物质的化学式为__________________ 。加热到210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________________________ 。温度高于890℃时,固体产物发生分解反应,固体产物为________________ 。

已知:物质溶解性:LiF难溶于水,Li2CO3微溶于水
请回答:
(1)Ⅰ中发生反应的化学方程式为
(2)写出步骤Ⅰ中Co2O3 与盐酸反应生成Cl2的离子方程式:
(3)废渣中的主要成分除了LiF外,还有
(4) NaF与溶液中的Li+形成LiF 沉淀,此反应对步骤Ⅳ所起的作用是
(5)在空气中加热10.98g 草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4·2H2O)= 183g/mol。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 290~320 | 4. 82 |
| 890~920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为
您最近一年使用:0次
4 . 亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________ .
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________ 。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______ 千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________ (填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________ 。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
该样品中亚硝酸钠的质量分数为_________ .(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
(1)NaNO2 中 N 元素的化合价为
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
您最近一年使用:0次
2018-04-10更新
|
446次组卷
|
3卷引用:陕西省2018届高三教学质量检测二(二模)理综化学试题
名校
5 . 实验室可通过反应;3Cl2+6KOH 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。

请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_______________________________ 。
(2)请分析装置图,进行补充和完善。A部分缺___________ 装置,B部分还应补充____________ 装置,还有一处设计明显不合理的是___________ (填“A”“B”或“C”)
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:______________________________________ 。
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______________ ;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________ (不考虑Cl2的挥发)

(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 mol•L-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 mol•L-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为_________ 。(已知Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,C1O3-可被Fe2+还原为Cl-)
 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:
(2)请分析装置图,进行补充和完善。A部分缺
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是

(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 mol•L-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 mol•L-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为
您最近一年使用:0次
2018-01-18更新
|
314次组卷
|
2卷引用:贵州省贵阳市第一中学2018届高三第五次适应性月考理综化学试题
名校
6 . 已知,在木炭还原氧化铜的实验中发生的主要反应是C+2CuO 2Cu+CO2↑。某化学实验小组对该实
2Cu+CO2↑。某化学实验小组对该实
验产物(假设已完全反应)进行了如下探究:
探究一:检验产物的成分
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体,那么该暗红色固体物质是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到_______________ ,说明猜想正确。
探究二:测定产物中Cu2O的含量

【查阅资料】草酸在浓硫酸的作用下会分解为CO和CO2
【设计实验】称取固体样品6.0g,置于上右图装置D中进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(1)证明草酸的分解产物中有CO2存在的是_______________ 。
(2)装置C的作用是__________________ 。
(3)写出装置D中反应的化学方程式___________________________ 。
(4)下列为加热装置前所涉及的部分操作,正确的顺序是_________ (填序号)。
①检查装置的气密性 ②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器 ④关闭K1,打开K2
(5)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为__________ 。
指出该装置的不足之处,说明不足的理由并给出改进方案__________________ 。
 2Cu+CO2↑。某化学实验小组对该实
2Cu+CO2↑。某化学实验小组对该实验产物(假设已完全反应)进行了如下探究:
探究一:检验产物的成分
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体,那么该暗红色固体物质是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到
探究二:测定产物中Cu2O的含量

【查阅资料】草酸在浓硫酸的作用下会分解为CO和CO2
【设计实验】称取固体样品6.0g,置于上右图装置D中进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(1)证明草酸的分解产物中有CO2存在的是
(2)装置C的作用是
(3)写出装置D中反应的化学方程式
(4)下列为加热装置前所涉及的部分操作,正确的顺序是
①检查装置的气密性 ②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器 ④关闭K1,打开K2
(5)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为
指出该装置的不足之处,说明不足的理由并给出改进方案
您最近一年使用:0次
名校
7 . 血液中的钙离子平衡在临床医学中具有重要的意义。某研究小组为测定血液样品中Ca2+的含量,进行的实验如下:
①量取5.0 mL血液样品,处理后配制成100 mL溶液;
②量取10.0 mL溶液,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得的CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入0.001 mol·L-1的酸性KMnO4溶液,使H2C2O4完全氧化,同时产生使澄清石灰水变浑浊的无色无味气体,消耗酸性KMnO4溶液的体积为2.00 mL。
(1)步骤①中用到的玻璃仪器有玻璃棒、烧杯、量筒、________________________ 。
(2)步骤②中发生反应的离子方程式为_______________________________________ 。
(3)步骤④中发生反应的离子方程式为__________________________ ;氧化产物与还原产物的物质的量之比为___________________ 。
(4)血样中Ca2+的含量为________ g·mL-1。
①量取5.0 mL血液样品,处理后配制成100 mL溶液;
②量取10.0 mL溶液,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得的CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入0.001 mol·L-1的酸性KMnO4溶液,使H2C2O4完全氧化,同时产生使澄清石灰水变浑浊的无色无味气体,消耗酸性KMnO4溶液的体积为2.00 mL。
(1)步骤①中用到的玻璃仪器有玻璃棒、烧杯、量筒、
(2)步骤②中发生反应的离子方程式为
(3)步骤④中发生反应的离子方程式为
(4)血样中Ca2+的含量为
您最近一年使用:0次
名校
8 . 肼(N2H4)是一种重要的液态火箭燃料,具有弱碱性和强还原性.工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4•H2O)、Na2CO3等产物.请回答:
(1)上述生成水合肼的反应中尿素是________ ( 填“氧化剂”或“还原剂”),反应的化学方程式为________ .
(2)肼与盐酸反应可生成N2H6Cl2 , N2H6Cl2的水溶液显________ 性( 填“酸”或“碱”或“中”),用离子方程式表示其原因________ .
(3)查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜.取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在高温下恰好完全反应生成氮气等产物,写出该反应的化学方程式________ .
若要设计实验方案检验上述反应生成固体产物中的金属阳离子,补充完整下列实验步骤:
①所得固体溶入浓盐酸中; ②________
(1)上述生成水合肼的反应中尿素是
(2)肼与盐酸反应可生成N2H6Cl2 , N2H6Cl2的水溶液显
(3)查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜.取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在高温下恰好完全反应生成氮气等产物,写出该反应的化学方程式
若要设计实验方案检验上述反应生成固体产物中的金属阳离子,补充完整下列实验步骤:
①所得固体溶入浓盐酸中; ②
您最近一年使用:0次
2017-06-29更新
|
284次组卷
|
2卷引用:苏教版2017届高三单元精练检测二化学试题
名校
9 . 菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结石。某化学兴趣小组对“菠菜豆腐是否不能同食”等问题进行了探究。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【提出猜想】“菠菜豆腐不能同食”的原因可能是____________ 。
【探究一】菠菜中部分成分分析

(1)步骤③中判断加入的CaCl2溶液已足量的方法是___________ 。
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式________________ 。沉淀A、B的质量关系为:m(A)_________ m(B)(填“>”、“<”或“=”)。
(3)白色沉淀B的化学式为_________ ,由此可见菠菜豆腐不能同食。以下饮食观点正确的是__________ (填字母)
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究
(提示:CaC2O4·xH2O受热会失去结晶水成为CaC2O4 ;白色硫酸铜粉末遇水会变蓝。)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
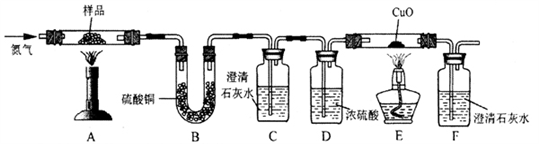
(4)①反应开始前通入氮气的目的是___________ ,装置C的作用是_______________ 。
②装置B中硫酸铜粉末变蓝,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物有__________________ ,经检验A中残留固体为氧化物。
③对上述装置从环保角度提一个改进建议_____________ 。
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,
获得相关数据,绘制成固体质量—分解温度的关系如图。

①800℃以上时,固体成分的化学式为_______ 。
②残留固体为CaC2O4时的温度范围__________ 。
③写出固体质量由12.8g变为10.0g时的化学方程式________________ 。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【提出猜想】“菠菜豆腐不能同食”的原因可能是
【探究一】菠菜中部分成分分析

(1)步骤③中判断加入的CaCl2溶液已足量的方法是
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式
(3)白色沉淀B的化学式为
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究
(提示:CaC2O4·xH2O受热会失去结晶水成为CaC2O4 ;白色硫酸铜粉末遇水会变蓝。)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)

(4)①反应开始前通入氮气的目的是
②装置B中硫酸铜粉末变蓝,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物有
③对上述装置从环保角度提一个改进建议
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,
获得相关数据,绘制成固体质量—分解温度的关系如图。

①800℃以上时,固体成分的化学式为
②残留固体为CaC2O4时的温度范围
③写出固体质量由12.8g变为10.0g时的化学方程式
您最近一年使用:0次
名校
10 . KClO3晶体是一种常见的氧化剂,生产工艺如图所示:
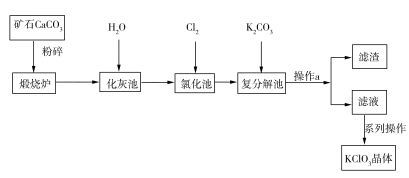
请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________ 。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________ 。该反应中,氧化剂与还原剂的物质的量之比为________ 。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________ 。
(4)实验室制取KClO3可通过反应:3Cl2+6KOH 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________ ;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________ 。(不考虑Cl2的挥发)

(5)甲同学为测定制取的KClO3样品中ClO3−的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L−1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中ClO3−的质量分数为______________ 。(已知:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)
2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)

请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:
(3)操作a中所需的玻璃仪器有漏斗、烧杯、
(4)实验室制取KClO3可通过反应:3Cl2+6KOH
 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是
(5)甲同学为测定制取的KClO3样品中ClO3−的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L−1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中ClO3−的质量分数为
 2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)
2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)
您最近一年使用:0次
2017-09-13更新
|
395次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2018届高三上学期第一次模拟考试化学试题



