10-11高三上·上海浦东新·期末
1 . 已知NaHCO3在潮湿的空气中会缓慢分解。取没有妥善保管已部分变质的NaHCO3样品a g,溶于水配成溶液,慢慢滴入0.200mol/L稀盐酸并不停地搅拌,反应过程中测得溶液中NaHCO3的质量与加入盐酸的体积之间的关系如图所示。
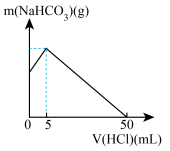
(1)a g样品中含Na2CO3的质量为____________ g。
(2)a g样品未变质前NaHCO3的质量为________ g。
(3)若另取样品b g,充分加热以后得到固体质量为5.300g,则b=_____________ g。

(1)a g样品中含Na2CO3的质量为
(2)a g样品未变质前NaHCO3的质量为
(3)若另取样品b g,充分加热以后得到固体质量为5.300g,则b=
您最近一年使用:0次
11-12高三上·上海松江·期中
2 . 将1.68克铁粉投入100mL稀硝酸中,两物质恰好完全反应,硝酸的还原产物全部是NO。向反应后的溶液中加入一定量的NaOH溶液,恰好使铁元素完全转化为沉淀,过滤,将滤渣洗涤、干燥、灼烧、称重,得固体a克,把滤液蒸干、灼烧、称重,得固体b克。根据题意完成下面小题:
(1)此硝酸的物质的量浓度范围是_____________________ ;
(2)a克固体的成份是_____________ ,质量为_______________ 克;
b克固体的成份是_____________ ,质量范围为_____________________ 克。
(3)假如反应中放出NO的体积(标况下)为582.4 mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为_____________ 。
(4)已知:25℃时NaOH的溶解度为118克/100克水。25℃时,把15克NaOH固体溶解在一定量水中,配成20克溶液,其密度为1.44g/mL。用该溶液去沉淀铁与硝酸反应后的溶液中的全部铁元素,至少需要取该NaOH溶液______ mL。
(1)此硝酸的物质的量浓度范围是
(2)a克固体的成份是
b克固体的成份是
(3)假如反应中放出NO的体积(标况下)为582.4 mL,若向铁与硝酸反应后的溶液中继续加入铁屑,该溶液还能溶解的铁的质量为
(4)已知:25℃时NaOH的溶解度为118克/100克水。25℃时,把15克NaOH固体溶解在一定量水中,配成20克溶液,其密度为1.44g/mL。用该溶液去沉淀铁与硝酸反应后的溶液中的全部铁元素,至少需要取该NaOH溶液
您最近一年使用:0次
3 . 欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下:
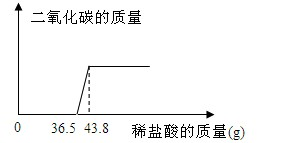
(1)求反应完毕后产生二氧化碳的质量?
(2)原固体中氢氧化钠的质量分数是多少?(结果保留一位小数)

(1)求反应完毕后产生二氧化碳的质量?
(2)原固体中氢氧化钠的质量分数是多少?(结果保留一位小数)
您最近一年使用:0次
4 . 0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
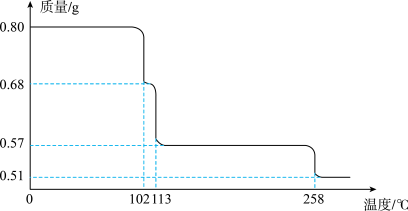
请回答下列问题:
(1)试确定200℃时固体物质的化学式_______ (要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是_______ ,把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_______ ,其存在的最高温度是_______ ;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为_______ 。
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_______ mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1 硫酸铜溶液中通入过量 H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______ mol·L-1。

请回答下列问题:
(1)试确定200℃时固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的主要产物是
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
您最近一年使用:0次
解题方法
5 . 硫代硫酸钠 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。
(1)实验室可通过向含 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。

①写出制备 的化学方程式:
的化学方程式:________________ 。
②“一系列操作”包括________ 、________ 、过滤、洗涤、干燥。(填操作名称)
(2)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:_______ 。
(3)临床上, 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: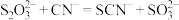 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为________________ 。
(4)工业上,测定 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。
相关反应: ;
;
 。
。
①该样品中 的质量分数为
的质量分数为________ (假设杂质不参与反应)。
②如果稀硫酸过多,测得结果会________ (填“偏高”、“偏低”或“无影响”)。
 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。(1)实验室可通过向含
 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。
①写出制备
 的化学方程式:
的化学方程式:②“一系列操作”包括
(2)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:(3)临床上,
 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: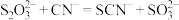 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为(4)工业上,测定
 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。相关反应:
 ;
; 。
。①该样品中
 的质量分数为
的质量分数为②如果稀硫酸过多,测得结果会
您最近一年使用:0次
6 . 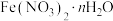 可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有
可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有 、
、 、
、 、
、 ,其中水的质量为6.300g,残留的固体产物是
,其中水的质量为6.300g,残留的固体产物是 ,质量为4.800g。
,质量为4.800g。
(1)n=_______ (写出计算过程)。
(2)在标准状况下气体产物中 的体积为
的体积为_______ L。
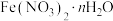 可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有
可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有 、
、 、
、 、
、 ,其中水的质量为6.300g,残留的固体产物是
,其中水的质量为6.300g,残留的固体产物是 ,质量为4.800g。
,质量为4.800g。(1)n=
(2)在标准状况下气体产物中
 的体积为
的体积为
您最近一年使用:0次
真题
名校
7 . 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3,质量为1.02g。计算:
(1)x=_______ (写出计算过程)。
(2)气体产物中n(O2)_______ mol。
(1)x=
(2)气体产物中n(O2)
您最近一年使用:0次
2022-01-12更新
|
4556次组卷
|
6卷引用:2022 年1月浙江省普通高校招生选考科目考试化学试题
2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)2022年浙江1月高考真题变式题(26-31)(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题浙江省东阳市横店高级中学2022-2023学年高三上学期10月份检测化学试题(已下线)微专题 化学计算的思想方法
解题方法
8 . 镁及其化合物在工业上有广泛的应用。
完成下列计算:
(1)称取某镁铝合金10g,放入100mL3mol/L的NaOH溶液中,完全反应收集到6.72L的H2(标准状况)。该合金中镁的质量分数为___ 。
(2)将镁条在空气中燃烧后的产物溶解在50mL1.6mol/L的盐酸中恰好完全反应,再加入过量NaOH把NH3全部蒸发出来,经测定NH3为0.102g,则镁条在空气中燃烧的产物及质量为___ 。
(3)Mg(HCO3)2溶液加热分解,得到产品轻质碳酸镁。18.2g轻质碳酸镁样品经高温完全分解后得8.0g氧化镁固体,放出3.36L二氧化碳(标准状况),求轻质碳酸镁的化学式___ 。
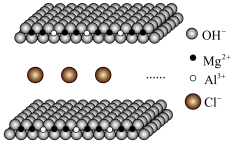
(4)氯离子插层的镁铝水滑石(Mg-Al-ClLDHs)是一种新型的阴离子交换材料。其结构示意图如图所示(每一层可视作平面无限延伸结构)。该离子交换原理是将插层离子与其它阴离子进行等电荷交换。取镁铝水滑石10.66g与0.02molNa2CO3发生完全交换,产物在高温下完全分解,得到金属氧化物和气体。将金属氧化物加入稀硝酸完全溶解后,再加入NaOH溶液直至过量,最终得到4.64g白色沉淀。求Mg-Al-ClLDHs的化学式___ 。
完成下列计算:
(1)称取某镁铝合金10g,放入100mL3mol/L的NaOH溶液中,完全反应收集到6.72L的H2(标准状况)。该合金中镁的质量分数为
(2)将镁条在空气中燃烧后的产物溶解在50mL1.6mol/L的盐酸中恰好完全反应,再加入过量NaOH把NH3全部蒸发出来,经测定NH3为0.102g,则镁条在空气中燃烧的产物及质量为
(3)Mg(HCO3)2溶液加热分解,得到产品轻质碳酸镁。18.2g轻质碳酸镁样品经高温完全分解后得8.0g氧化镁固体,放出3.36L二氧化碳(标准状况),求轻质碳酸镁的化学式
(4)氯离子插层的镁铝水滑石(Mg-Al-ClLDHs)是一种新型的阴离子交换材料。其结构示意图如图所示(每一层可视作平面无限延伸结构)。该离子交换原理是将插层离子与其它阴离子进行等电荷交换。取镁铝水滑石10.66g与0.02molNa2CO3发生完全交换,产物在高温下完全分解,得到金属氧化物和气体。将金属氧化物加入稀硝酸完全溶解后,再加入NaOH溶液直至过量,最终得到4.64g白色沉淀。求Mg-Al-ClLDHs的化学式

您最近一年使用:0次
解题方法
9 . 某天然碱可以看作是CO2 和 NaOH 反应后的产物组成的一种物质。为了研究该物质的组成,进行如下实验:
ⅰ称取 3.98 g 天然碱样品,加入 50mL 稀盐酸(足量),产生 CO2 896mL(标准状况)。
ⅱ称取 3.98g 天然碱样品,加热至分解完全,产生 CO2 224mL(标准状况)和 0.36g 水。
①该稀盐酸的物质的量浓度最小是_____________ 。
②天然碱的化学式是_____________ 。
ⅰ称取 3.98 g 天然碱样品,加入 50mL 稀盐酸(足量),产生 CO2 896mL(标准状况)。
ⅱ称取 3.98g 天然碱样品,加热至分解完全,产生 CO2 224mL(标准状况)和 0.36g 水。
①该稀盐酸的物质的量浓度最小是
②天然碱的化学式是
您最近一年使用:0次
10 . 蛋氨酸铜[Cux(Met)y,Met表示蛋氨酸根离子]是一种新型饲料添加剂。为确定蛋氨酸铜[Cux(Met)y]的组成,进行如下实验:
(1)称取一定质量的样品于锥形瓶中,加入适量的蒸馏水和稀盐酸,加热至全部溶解,冷却后将溶液分成两等份。
②取其中一份溶液,调节溶液pH在6~8之间。加入0.1000 mol/LI2的标准溶液25.00 mL,充分反应后滴入2~3滴指示剂X,用0.1000 mol/LNa2S2O3标准溶液滴定至蓝色恰好褪去,发生反应: 。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
③向另一份溶液中加入NH3·H2O-NH4Cl缓冲溶液,加热至70℃左右,滴入2-3滴指示剂PAN,用0.02500 mol/LEDTA (Na2H2Y)标准溶液滴定其中Cu2+(离子方程式为Cu2++H2Y2--=CuY2-+2H+),消耗EDTA标准溶液28.00 mL。
(1)指示剂X为____ 。
(2)用Na2S2O3标准液滴定时,若pH过小,会有S和SO2生成。写出S2O32-与H+反应的离子方程式___________ 。
(3)若滴定管水洗后未用EDTA标准溶液润洗,测得Cu2+的物质的量将____ (填“偏大”、“偏小”或“不变”)。
(4)通过计算确定蛋氨酸铜[Cux(Met)y]的化学式(写出计算过程)________ 。
(1)称取一定质量的样品于锥形瓶中,加入适量的蒸馏水和稀盐酸,加热至全部溶解,冷却后将溶液分成两等份。
②取其中一份溶液,调节溶液pH在6~8之间。加入0.1000 mol/LI2的标准溶液25.00 mL,充分反应后滴入2~3滴指示剂X,用0.1000 mol/LNa2S2O3标准溶液滴定至蓝色恰好褪去,发生反应:
 。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。③向另一份溶液中加入NH3·H2O-NH4Cl缓冲溶液,加热至70℃左右,滴入2-3滴指示剂PAN,用0.02500 mol/LEDTA (Na2H2Y)标准溶液滴定其中Cu2+(离子方程式为Cu2++H2Y2--=CuY2-+2H+),消耗EDTA标准溶液28.00 mL。
(1)指示剂X为
(2)用Na2S2O3标准液滴定时,若pH过小,会有S和SO2生成。写出S2O32-与H+反应的离子方程式
(3)若滴定管水洗后未用EDTA标准溶液润洗,测得Cu2+的物质的量将
(4)通过计算确定蛋氨酸铜[Cux(Met)y]的化学式(写出计算过程)
您最近一年使用:0次
2020-04-04更新
|
298次组卷
|
2卷引用:江苏省七市(南通、泰州、扬州、徐州、淮安、连云港、宿迁)2020届高三第二次调研考试化学试题



