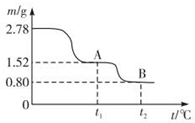
1 . 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中煅烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
(1)绿矾油主要成份的化学式为_________ .t1~t2.发生反应的化学方程式为_________________ .
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为_________ .
(3)以下是FeSO4•7H2O的实验室制备流理图.
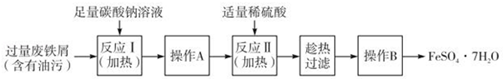
根据题意完成下列填空:
①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及____________ .
②操作A的名称为_____________ .
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为_______________ ,计算上述样品中FeSO4•7H2O的质量分数为_________ (保留两位有效数字).
(1)绿矾油主要成份的化学式为
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为
(3)以下是FeSO4•7H2O的实验室制备流理图.

根据题意完成下列填空:

①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及
②操作A的名称为
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为
您最近一年使用:0次
2 . 高铁酸钾(K2FeO4)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(已知:Fe3++3H2O⇌Fe(OH)3+3H+)
(1)高铁酸钾可用于杀菌消毒,是因为它具有强___________ 性。
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为________ 。这种分散系区分于其他分散系的最本质区别是_________ 。
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______ +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。
①完成上述离子方程式:___________ 。
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
湿法制备高铁酸钾的流程如下图。
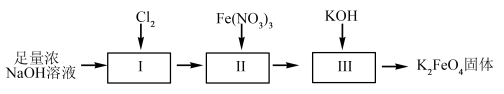
(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。___________ ,反应每生成1molCl-转移的电子数目为___________ 。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

(1)高铁酸钾可用于杀菌消毒,是因为它具有强
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______
 +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。①完成上述离子方程式:
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为
湿法制备高铁酸钾的流程如下图。

(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

| A.24℃,75g∙L-1 | B.26℃,75g∙L-1 | C.28℃,75g∙L-1 | D.22℃,80g∙L-1 |
您最近一年使用:0次
3 . 草酸亚铁晶体( ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。

(1)按照气流从左到右的方向,上述装置的接口顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有 ,依据的实验现象为
,依据的实验现象为_______ 。
(3)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(5)工业制得的草酸亚铁晶体中常含有 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品溶于稀 中,配成250 mL溶液;
中,配成250 mL溶液;
步骤2:取上述溶液25.00 mL,用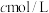
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 ,再用
,再用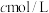
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。
①步骤2中滴定终点的现象为_______ 。
②该样品中草酸亚铁晶体的质量分数的表达式为_______ 。
③若步骤1配制溶液时部分 被氧化变质,则测定结果将
被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。
 ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
(1)按照气流从左到右的方向,上述装置的接口顺序为A→
(2)实验证明了气体产物中含有
 ,依据的实验现象为
,依据的实验现象为(3)实验证明了气体产物中含有CO,依据的实验现象为
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(5)工业制得的草酸亚铁晶体中常含有
 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:步骤1:称取m g草酸亚铁晶体样品溶于稀
 中,配成250 mL溶液;
中,配成250 mL溶液;步骤2:取上述溶液25.00 mL,用
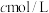
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀
 ,再用
,再用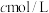
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的表达式为
③若步骤1配制溶液时部分
 被氧化变质,则测定结果将
被氧化变质,则测定结果将
您最近一年使用:0次
2022-12-16更新
|
190次组卷
|
2卷引用:辽宁省大连市滨城联盟2022-2023学年高三上学期期中(‖)考试化学试题
解题方法
4 . 漂白粉的主要成分是次氯酸钙和氯化钙。请回答下列问题:
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):____________________________ 。
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为_____________ (假设漂白粉中的其它成份不与硝酸反应)。
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为
您最近一年使用:0次
解题方法
5 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O,相对分子质量392]晶体又称莫尔盐,易溶易电离但却比一般的亚铁盐稳定,因此广泛应用于制药、电镀以及定量分析。回答下列与之有关的问题:
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是______________ ;
②其中处于同主族的两种元素非金属性更强的是:_____________ 。
(2)为检验莫尔盐是否变质,可用的试剂为_______________ 。
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:
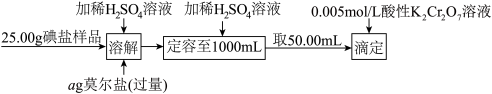
(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:______________________________ 。
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果_____________ (填“偏大”“偏小”或“无影响”)
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是
②其中处于同主族的两种元素非金属性更强的是:
(2)为检验莫尔盐是否变质,可用的试剂为
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:

(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果
您最近一年使用:0次
名校
解题方法
6 . 某科研小组对乙醛与新制Cu(OH)2反应的实验进行探究。文献资料:
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O Cu+Cu2+。
Cu+Cu2+。
Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
(1)实验ⅰ中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4的化学方程式___________ 。
(2)实验ⅰ、ⅱ、ⅲ中,实验___________ 的新制Cu(OH)2浊液与乙醛反应生成了Cu2O。
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
① 由实验ⅳ的现象推测:实验ⅱ的黑色沉淀是___________ 。
② 实验ⅴ能够产生砖红色沉淀的原因是___________ (结合微粒符号解释),写出实验ⅴ中该微粒与乙醛发生反应的方程式___________ 。
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:___________ ,加热,无色溶液先变为亮黄色,逐渐加深为橙黄色。
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式___________ 。
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是___________ 。
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ | 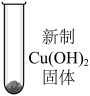 | 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
您最近一年使用:0次
2023-07-10更新
|
141次组卷
|
2卷引用:北京市石景山区2022-2023学年高二下学期期末考试化学试题
名校
7 . (1)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤
②不通入氨,冷却、加食盐,过滤。两种方法中___________ (填编号) 析出的氯化铵纯度更高
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成份是___________ (填化学式)。写出产生白烟化学方程式___________ 。
(3)TiO2的熔沸点远高于CO2的原因是___________ ,MgTiO3的熔点高于BaTiO3的原因是___________ 。
(4)
②不通入氨,冷却、加食盐,过滤。两种方法中
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成份是
(3)TiO2的熔沸点远高于CO2的原因是
(4)
| 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| H2O(Br2) | ||
| 氯化镁溶液(氯化铁) |
您最近一年使用:0次
解题方法
8 . 钠的化合物是化工生产与科学研究的重要组成部分。
(1)将Na、 、
、 、NaOH长时间露置在空气中,最终都会变为
、NaOH长时间露置在空气中,最终都会变为______ (填化学式)。
(2)探究某 样品是否已经变质:取少量
样品是否已经变质:取少量 样品,将其溶于水,加入
样品,将其溶于水,加入 溶液,充分振荡后,观察到
溶液,充分振荡后,观察到_______ (填实验现象),则说明 样品已经与空气中的
样品已经与空气中的 发生反应变质。
发生反应变质。
(3)“神舟号”载人航天器的返回舱内,为防止 浓度过大引起宇航员困乏,可用
浓度过大引起宇航员困乏,可用 降低
降低 的浓度,有关反应的化学方程式为
的浓度,有关反应的化学方程式为_______ ;用 (超氧化钾)代替
(超氧化钾)代替 也能达到同样的目的,反应产物也很相似,试计算用
也能达到同样的目的,反应产物也很相似,试计算用 和
和 分别与
分别与 反应,产生等质量的
反应,产生等质量的 ,所需
,所需 和
和 的质量比为
的质量比为_____ (填最简整数比)。
(4)食品工业经常把 和
和 用作膨松剂,室温下向含某膨松剂试样(
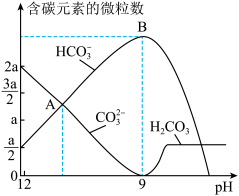
用作膨松剂,室温下向含某膨松剂试样(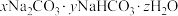 )的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知:
)的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知: 因有逸出未画出;
因有逸出未画出; 与少量盐酸发生下列反应:
与少量盐酸发生下列反应: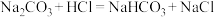 )。
)。
①x:y=____ 。
②图中B点溶液溶质的主要成分为_______ (填化学式),B点后发生反应的离子方程式为______ 。
(1)将Na、
 、
、 、NaOH长时间露置在空气中,最终都会变为
、NaOH长时间露置在空气中,最终都会变为(2)探究某
 样品是否已经变质:取少量
样品是否已经变质:取少量 样品,将其溶于水,加入
样品,将其溶于水,加入 溶液,充分振荡后,观察到
溶液,充分振荡后,观察到 样品已经与空气中的
样品已经与空气中的 发生反应变质。
发生反应变质。(3)“神舟号”载人航天器的返回舱内,为防止
 浓度过大引起宇航员困乏,可用
浓度过大引起宇航员困乏,可用 降低
降低 的浓度,有关反应的化学方程式为
的浓度,有关反应的化学方程式为 (超氧化钾)代替
(超氧化钾)代替 也能达到同样的目的,反应产物也很相似,试计算用
也能达到同样的目的,反应产物也很相似,试计算用 和
和 分别与
分别与 反应,产生等质量的
反应,产生等质量的 ,所需
,所需 和
和 的质量比为
的质量比为(4)食品工业经常把
 和
和 用作膨松剂,室温下向含某膨松剂试样(
用作膨松剂,室温下向含某膨松剂试样(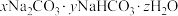 )的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知:
)的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知: 因有逸出未画出;
因有逸出未画出; 与少量盐酸发生下列反应:
与少量盐酸发生下列反应: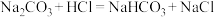 )。
)。①x:y=
②图中B点溶液溶质的主要成分为

您最近一年使用:0次
2024高三下·全国·专题练习
9 . 测定CrCl3产品的纯度,实验如下:
①取mg CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO ,继续加热一段时间;
,继续加热一段时间;
②冷却后,滴入适量的稀硫酸和浓磷酸,使CrO 转化为Cr2O
转化为Cr2O ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;
③取25.00mL溶液,用新配制的 的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被
被 还原为Cr3+)。
还原为Cr3+)。
则样品中CrCl3 (摩尔质量为M g·molˉ1)的质量分数为___________ %;若步骤③中所用标准溶液已变质,将导致CrCl3质量分数测定值___________ (填“偏高”、“偏低”或“无影响”)。
①取mg CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;②冷却后,滴入适量的稀硫酸和浓磷酸,使CrO
 转化为Cr2O
转化为Cr2O ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;③取25.00mL溶液,用新配制的
 的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被
被 还原为Cr3+)。
还原为Cr3+)。则样品中CrCl3 (摩尔质量为M g·molˉ1)的质量分数为
您最近一年使用:0次
名校
10 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当容易变质。某实验小组以过氧化钠为研究对象,进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品溶解,___________ (填写实验操作和现象),证明Na2O2已变质。
(2)该实验小组为了测定已变质的过氧化钠中Na2O2的质量分数,称取a g样品,并设计了如图所示的装置。
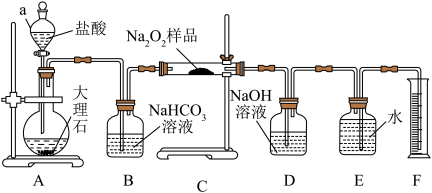
①装置A中仪器a的名称是___________ ,装置B的作用是___________ 。
②将仪器连接好以后,必须进行的操作是___________ 。
③写出装置C中发生反应的化学方程式:___________ 。
④实验结束后,在读取生成气体的体积时,你认为合理的是___________ (填序号)。
a.直接读取体积,不需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低处相平
⑤读出量筒内水的体积后,折算成标准状况下气体的体积为V mL,则该样品中过氧化钠的质量分数为___________ 。
(1)探究一包Na2O2样品是否已经变质:取少量样品溶解,
(2)该实验小组为了测定已变质的过氧化钠中Na2O2的质量分数,称取a g样品,并设计了如图所示的装置。

①装置A中仪器a的名称是
②将仪器连接好以后,必须进行的操作是
③写出装置C中发生反应的化学方程式:
④实验结束后,在读取生成气体的体积时,你认为合理的是
a.直接读取体积,不需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低处相平
⑤读出量筒内水的体积后,折算成标准状况下气体的体积为V mL,则该样品中过氧化钠的质量分数为
您最近一年使用:0次



