解题方法
1 . I.由三种元素组成的化合物A,相对分子质量为62,常温下为无色晶体,易分解、易爆炸,水溶液中相对稳定,是一种二元弱酸,一定条件下还可用作还原剂。A的制备可以由工业盐经过如下步骤实现:

已知:钠汞齐是一种强还原剂,由钠溶于汞形成;C是氯碱工业产物之一。请回答:
(1)A的结构式:__________ (A中所有原子都满足稀有气体的最外层电子结构)。
(2)工业盐生成B和C的化学方程式:__________ 。
(3)请设计实验证明A是一种二元弱酸:__________ 。
II.为检验某纯碱样品中是否含有碳酸氢钠,可采用不同的方法。
实验室提供下列仪器与药品:酒精灯、铁架台及固定装置、带玻璃导管的单孔橡胶塞、试管、胶头滴管、蒸馏水、CaCl2溶液、澄清石灰水、酚酞试液、盐酸、NaOH溶液。
请根据所提供的仪器与药品设计两个可行的实验方案:__________ 。

已知:钠汞齐是一种强还原剂,由钠溶于汞形成;C是氯碱工业产物之一。请回答:
(1)A的结构式:
(2)工业盐生成B和C的化学方程式:
(3)请设计实验证明A是一种二元弱酸:
II.为检验某纯碱样品中是否含有碳酸氢钠,可采用不同的方法。
实验室提供下列仪器与药品:酒精灯、铁架台及固定装置、带玻璃导管的单孔橡胶塞、试管、胶头滴管、蒸馏水、CaCl2溶液、澄清石灰水、酚酞试液、盐酸、NaOH溶液。
请根据所提供的仪器与药品设计两个可行的实验方案:
您最近一年使用:0次
解题方法
2 . 通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
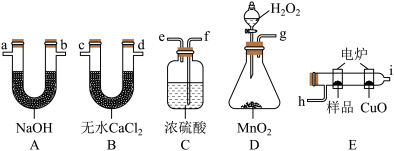
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是___ (填字母)。
(2)装置C中浓硫酸的作用是___ 。
(3)燃烧管中CuO的作用是___ 。
(4)若准确称取0.69g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32g,B管质量增加0.81g,则该有机物的实验式为___ 。
(5)经测定其蒸气密度为2.054g/L(已换算为标准状况),则其分子式为___ 。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为___ 。
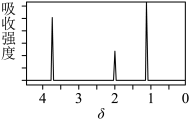

请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是
(2)装置C中浓硫酸的作用是
(3)燃烧管中CuO的作用是
(4)若准确称取0.69g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32g,B管质量增加0.81g,则该有机物的实验式为
(5)经测定其蒸气密度为2.054g/L(已换算为标准状况),则其分子式为
(6)该物质的核磁共振氢谱如图所示,则其结构简式为

您最近一年使用:0次
20-21高二上·浙江·期中
解题方法
3 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如图装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2;②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与 反应生成
反应生成 和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是___________ 。
(2)装置A中发生反应的化学方程式为______ 。实验结束后,将B瓶中的溶液经蒸发浓缩、_______ (填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为________ ,其中盛放的药品为___________ (填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,___________ ,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如表所示:
根据表中数据,计算所得固体中亚硝酸钠的质量分数___________ 。

已知:①2NO+Na2O2=2NaNO2;②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与
 反应生成
反应生成 和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。(1)加热装置A前,先通一段时间N2,目的是
(2)装置A中发生反应的化学方程式为
(3)仪器C的名称为
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(5)为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
您最近一年使用:0次
名校
4 . 氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是 和Cl-。研究小组用如下实验装置取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如下实验装置取氯酸钾(KClO3),并测定其纯度。
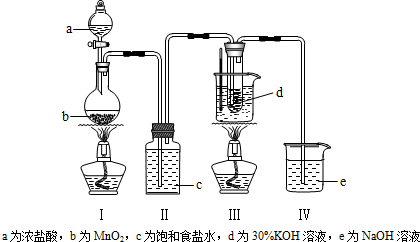
A为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液。回答下列问题;
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I的作用是制备__________ ,反应的化学方程式为__________ 。
②若取消装置II,对本实验的影响是__________ 。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是__________ 。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和_______ 。
(2)已知碱性条件下,ClO-有强氧化性,而 氧化性很弱。设计实验证明“碱性条件下,H2O2能被ClO-氧化,而不能被
氧化性很弱。设计实验证明“碱性条件下,H2O2能被ClO-氧化,而不能被 氧化”:
氧化”:_________ (写出实验操作及现象)。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45 g样品溶于水配成250 mL溶液。
步骤2:取25.00 mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分反应,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(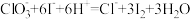 )
)
步骤4:加入指示剂,用0.5000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。( )
)
①步骤2的目的是_________ 。写出煮沸时反应的化学方程式_________ 。
②样品中KClO3的质量分数为_________ 。(KClO3式量:122.5)
 和Cl-。研究小组用如下实验装置取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如下实验装置取氯酸钾(KClO3),并测定其纯度。
A为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液。回答下列问题;
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I的作用是制备
②若取消装置II,对本实验的影响是
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和
(2)已知碱性条件下,ClO-有强氧化性,而
 氧化性很弱。设计实验证明“碱性条件下,H2O2能被ClO-氧化,而不能被
氧化性很弱。设计实验证明“碱性条件下,H2O2能被ClO-氧化,而不能被 氧化”:
氧化”:(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45 g样品溶于水配成250 mL溶液。
步骤2:取25.00 mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分反应,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(
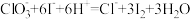 )
)步骤4:加入指示剂,用0.5000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。(
 )
)①步骤2的目的是
②样品中KClO3的质量分数为
您最近一年使用:0次
5 . 草酸亚铁晶体(FeC2O4•xH2O)在电池工业、制药、照片显影等方面有重要作用。在实验室中用制备草酸亚铁并研究其性质,具体流程如图:

已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2,Ka2=6.5×10-5;Ksp(FeC2O4•xH2O)=3.2×10-7
回答下列问题:
(1)步骤①用水溶解的过程中,加入少量稀H2SO4的作用是_____ 。
(2)步骤②中加入的H2C2O4属于_____ 酸,生成固体I的离子反应方程式为_____ 。
(3)步骤③中先用水洗涤,再用乙醇洗涤,其目的是_____ 。
(4)步骤④是检验草酸亚铁晶体加热分解后的产物H2O、CO、CO2,首先检验的气体为_____ ,然后将剩余气体依次通过_____ (填序号,装置可重复使用)→尾气处理。实验前需要将装置中的空气排尽,理由是_____ 。
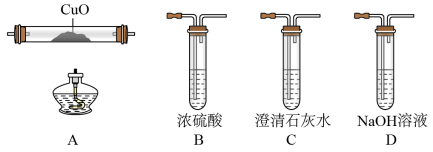
(5)步骤⑤采用滴定分析法测定FeC2O4•xH2O中x的值。取0.18g样品溶于稀硫酸配成100.00mL溶液,取20.00mL于锥形瓶中,用0.0100mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00mL。滴定终点的现象为_____ ,x值为_____ 。

已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2,Ka2=6.5×10-5;Ksp(FeC2O4•xH2O)=3.2×10-7
回答下列问题:
(1)步骤①用水溶解的过程中,加入少量稀H2SO4的作用是
(2)步骤②中加入的H2C2O4属于
(3)步骤③中先用水洗涤,再用乙醇洗涤,其目的是
(4)步骤④是检验草酸亚铁晶体加热分解后的产物H2O、CO、CO2,首先检验的气体为

(5)步骤⑤采用滴定分析法测定FeC2O4•xH2O中x的值。取0.18g样品溶于稀硫酸配成100.00mL溶液,取20.00mL于锥形瓶中,用0.0100mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00mL。滴定终点的现象为
您最近一年使用:0次
2020-05-19更新
|
335次组卷
|
4卷引用:广东省茂名市2020届高三第一次综合测试理综化学试题
广东省茂名市2020届高三第一次综合测试理综化学试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编陕西省宝鸡市宝鸡中学2020-2021学年高三上学期第一次月考化学试题(已下线)T27-实验题
名校
解题方法
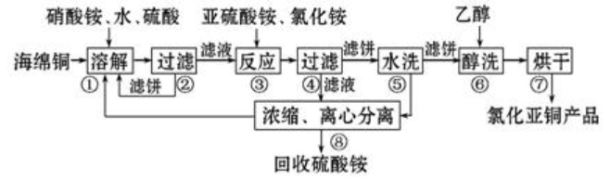
6 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是_________ ,溶解温度应控制在60~ 70℃,原因是________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。若向亚硫酸氢铵溶液中加入过量氢氧化钠溶液,反应的离子方程式为_____________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是________ 。
(5)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
2020-10-08更新
|
364次组卷
|
2卷引用:2016届黑龙江省大庆实验中学高三上学期开学考试化学试卷
7 . 在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种,它具有强氧化性,可将各种病原微生物杀灭。其性质不稳定,为无色透明液体,易溶于水易挥发,见光与热易分解。过氧化氢不同的浓度有不同的用途,某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验,其制备原理为:CH3COOH+H2O2 CH3COOOH+ H2O △H<0(在90.7℃时乙酸丁酯与水会形成共沸物及时分离出水,提高产率)
CH3COOOH+ H2O △H<0(在90.7℃时乙酸丁酯与水会形成共沸物及时分离出水,提高产率)
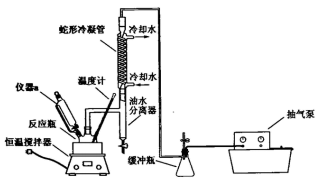
(1)装置中仪器a中盛放的试剂为________ ( 填“乙酸”或“双氧水”),其中使用油水分离器的优点是:_____________________ .
(2)下列有关过氧乙酸叙述正确的是________ 。
A.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应
B.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
C.过氧乙酸可用于手部、室内空气,桌椅和餐具的消毒,不能用于浸泡金属器械
D.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
(3)正确的实验步骤是a→( ) →( ) →( ) →( ) →d
a.连接好如图所示的装置,检查好气密性,在油水分离器中加满乙酸丁酯;
b.加入浓硫酸2mL,搅拌5h,低温避光阴凉处静置20h;
c.打开恒温搅拌器和通入冷却水,打开抽气泵将系统抽为真空并保持恒定;
d.将反应瓶中静置所得液体转移试剂瓶。贴上标签以备用。
e.向带有投拌装置及温度计的500mL反应瓶中加入一定量的反应物,乙酸丁酯和5 mL的磷酸作稳定剂;
f.在不断搅拌下将90 g 68%仪器a中试剂逐滴加入反应瓶;
(4)过氧乙酸 (含有少量H2O2杂质)的含量测定流程如图。
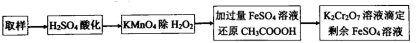
①过氧乙酸被Fe2+还源,还原产物之一为乙酸, 其离子方程式为______________ 。
②若样品体积为25.00mL,加入0.200 mol/LFeSO4溶液25.00mL,消耗0.100 mol/LK2Cr2O7溶液5.00 mL,则过氧乙酸含量为_____ g/L。若H2O2未完全除尽,则测定结果会____________ (填“偏高”、“偏低”或“无影响") (计算结果小数点后保留2位)。
 CH3COOOH+ H2O △H<0(在90.7℃时乙酸丁酯与水会形成共沸物及时分离出水,提高产率)
CH3COOOH+ H2O △H<0(在90.7℃时乙酸丁酯与水会形成共沸物及时分离出水,提高产率) 
(1)装置中仪器a中盛放的试剂为
(2)下列有关过氧乙酸叙述正确的是
A.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应
B.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
C.过氧乙酸可用于手部、室内空气,桌椅和餐具的消毒,不能用于浸泡金属器械
D.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
(3)正确的实验步骤是a→
a.连接好如图所示的装置,检查好气密性,在油水分离器中加满乙酸丁酯;
b.加入浓硫酸2mL,搅拌5h,低温避光阴凉处静置20h;
c.打开恒温搅拌器和通入冷却水,打开抽气泵将系统抽为真空并保持恒定;
d.将反应瓶中静置所得液体转移试剂瓶。贴上标签以备用。
e.向带有投拌装置及温度计的500mL反应瓶中加入一定量的反应物,乙酸丁酯和5 mL的磷酸作稳定剂;
f.在不断搅拌下将90 g 68%仪器a中试剂逐滴加入反应瓶;
(4)过氧乙酸 (含有少量H2O2杂质)的含量测定流程如图。

①过氧乙酸被Fe2+还源,还原产物之一为乙酸, 其离子方程式为
②若样品体积为25.00mL,加入0.200 mol/LFeSO4溶液25.00mL,消耗0.100 mol/LK2Cr2O7溶液5.00 mL,则过氧乙酸含量为
您最近一年使用:0次
8 . Ⅰ.绿色粉末状固体化合物X由三种元素组成,取50.4gX,用蒸馏水完全溶解得绿色溶液A,将溶液A分成A1和A2两等份,完成如下实验:
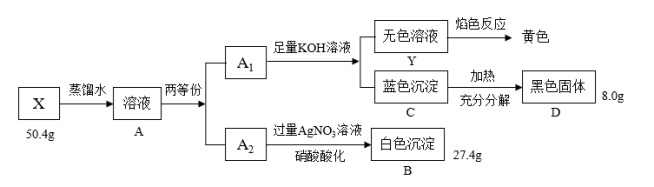
请回答
(1)X的化学式是____ 。
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:____ 。
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式____ 。
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是____ 。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中____ (填实验现象),则可证明三草酸合铁酸钾热分解的气体产物是H2O、CO、CO2。
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:____ 。

请回答
(1)X的化学式是
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:
您最近一年使用:0次
2020-11-30更新
|
330次组卷
|
2卷引用:浙江省十校联盟2021届高三10月联考化学试题
名校
解题方法
9 . 氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)

a 为浓盐酸,b 为 MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为_____________________________________ 。
②若取消装置 II,对本实验的影响是___________________ 。
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________ (填化学式)。
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是_________________ 。
②样品中 KClO3的貭量分数为_____ 。(保留三位有效数字,KClO3式量:122.5)

a 为浓盐酸,b 为 MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为
②若取消装置 II,对本实验的影响是
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是
②样品中 KClO3的貭量分数为
您最近一年使用:0次
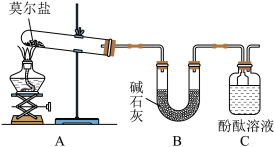
10 . 已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)可溶于水,在100℃~110℃时分解。为探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验,装置C中可观察到的现象是____________________ ,由此可知分解产物中有_________ 。
乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。
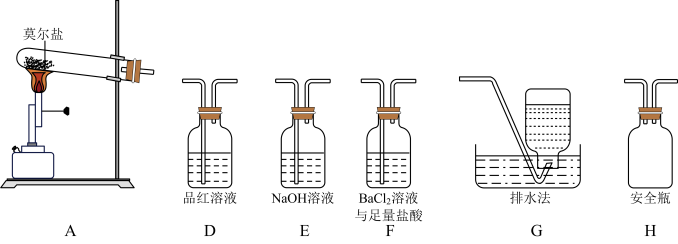
(2)乙同学的实验中,装置依次连接的合理顺序为:A→H→( ) →( ) →( ) →G。
(3)证明含有SO3的实验现象是______________ ;安全瓶H的作用是_________ 。
Ⅱ.为测定硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取25.00 mL样品溶液用0.1000 mol·L-1的酸性K2Cr2O7 溶液分三次进行滴定。
乙方案:(通过NH 测定)实验设计装置如下图所示。取25.00 mL样品溶液进行该实验。
测定)实验设计装置如下图所示。取25.00 mL样品溶液进行该实验。
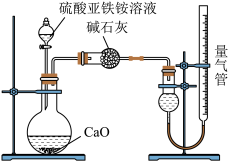
请回答:
(4)甲方案中的离子方程式为:________________ 。
(5)乙方案中量气管中最佳试剂是________
a 水 b 饱和NaHCO3溶液 c CCl4
(6)若测得NH3为V L(已折算为标准状况下),则硫酸亚铁铵纯度为_____ (列出计算式)。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验,装置C中可观察到的现象是

乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。

(2)乙同学的实验中,装置依次连接的合理顺序为:A→H→
(3)证明含有SO3的实验现象是
Ⅱ.为测定硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取25.00 mL样品溶液用0.1000 mol·L-1的酸性K2Cr2O7 溶液分三次进行滴定。
乙方案:(通过NH
 测定)实验设计装置如下图所示。取25.00 mL样品溶液进行该实验。
测定)实验设计装置如下图所示。取25.00 mL样品溶液进行该实验。
请回答:
(4)甲方案中的离子方程式为:
(5)乙方案中量气管中最佳试剂是
a 水 b 饱和NaHCO3溶液 c CCl4
(6)若测得NH3为V L(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次



