名校
1 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取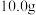 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
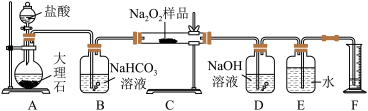
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
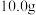 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
551次组卷
|
5卷引用:3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)
(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
2 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由实验现象可推知:____________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①将补全下列实验操作步骤正确排序da_____ e(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
②缓缓通入N2的目的是_________ 。
③根据实验记录,计算绿矾化学式中结晶水数目x=_________ (列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A(取出a g后)接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为BaCl2、品红。C、D中可观察到的现象分别为________ 、________ 。
②写出硫酸亚铁高温分解反应的化学方程式________ 。
(4)为了测定A中样品的纯度,将取出a g样品溶于水,配制成500 mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
上表中第一次实验中记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由实验现象可推知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①将补全下列实验操作步骤正确排序da
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
②缓缓通入N2的目的是
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A(取出a g后)接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为BaCl2、品红。C、D中可观察到的现象分别为
②写出硫酸亚铁高温分解反应的化学方程式
(4)为了测定A中样品的纯度,将取出a g样品溶于水,配制成500 mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
您最近一年使用:0次
2020-12-29更新
|
429次组卷
|
2卷引用:上海市嘉定区2021届高三一模化学试题
名校
解题方法
3 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
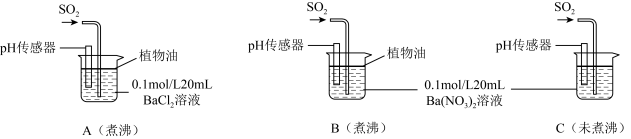
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
649次组卷
|
3卷引用:专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册
名校
解题方法
4 . 根据实验操作和现象,不能得出相应结论的是( )
选项 | 实验操作和现象 | 结论 |
A | 等体积、pH=3的两种酸HA和HB,分别与足量的Zn反应,酸HA放出的氢气多 | 酸性:HB>HA |
B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品溶于稀硫酸前已氧化变质 |
C | 将充满NO2的密闭玻璃球浸泡在热水中,气体红棕色加深 | 2NO2(g) N2O4(g),ΔH<0 N2O4(g),ΔH<0 |
D | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | 结合H+的能力: >C6H5O- >C6H5O- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-27更新
|
288次组卷
|
2卷引用:江西省鹰潭市第一中学2021-2022学年高二上学期创新班10月月考化学试题
解题方法
5 . 从下列事实所列出的相应结论正确的是
| 序号 | 实验事实 | 结论 |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 用磨口玻璃瓶保存NaOH溶液,硝酸用棕色试剂瓶保存在阴暗处 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解, | 证明Na2SO3已氧化变质 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A.①② | B.③④⑤ | C.②④ | D.④⑤ |
您最近一年使用:0次
2020-01-20更新
|
42次组卷
|
3卷引用:黑龙江绥化市第七中学校2020-2021学年高一下学期第二次月考化学试题
6 . 吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
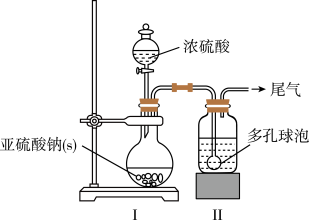
(1)装置Ⅰ中产生气体的化学反应方程式为__ ;Ⅱ中多孔球泡的作用是__ 。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__ 。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。
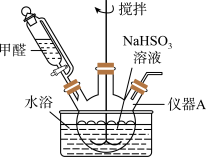
(3)仪器A的名称为___ ;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__ 。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__ 。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__ ;吊白块样品的纯度为__ %(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__ (填“偏高”、“偏低”或“无影响”)
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。

(1)装置Ⅰ中产生气体的化学反应方程式为
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为
(4)将仪器A中的反应温度恒定在80~90℃的目的是
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是
您最近一年使用:0次
2019-12-31更新
|
638次组卷
|
4卷引用:广东省广州市广大附中、广外、铁一三校2021-2022学年高三上学期期中联考化学试题
名校
7 . 化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________ 。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________ 。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)=____________ 。
(3)方案三:称取一定质量样品,按如图装置进行实验:
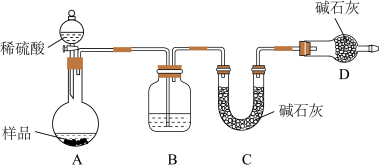
①B装置内所盛试剂是____________ ;
②D装置的作用是________ 。
③某同学认为上述测定结果__________ (填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________ 。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)=
(3)方案三:称取一定质量样品,按如图装置进行实验:

①B装置内所盛试剂是
②D装置的作用是
③某同学认为上述测定结果
您最近一年使用:0次
2019-12-05更新
|
235次组卷
|
3卷引用:专题3 第二单元 第2课时 碳酸钠 碳酸氢钠-高中化学苏教2019版必修第一册
8 . 某实验需要用到480 mL 0.1mol·L-1FeSO4溶液。下列说法正确的是
| A.选择480 mL容量瓶和100 mL量筒 |
| B.用Na2O2可检验样品是否变质 |
| C.转移溶液时,玻璃棒紧靠在容量瓶刻度线下方 |
| D.若定容时仰视刻度线,所配制溶液浓度偏大 |
您最近一年使用:0次
2019-11-03更新
|
130次组卷
|
2卷引用:河南省洛阳市第四十三中学2022届高三上学期开学考试化学试题
解题方法
9 . 氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。

Ⅰ.氮化锶的制取
(1)装置B仪器的名称是_____________ 。
(2)装置C、D、E盛装的试剂分别是_____________ (填代号)。
甲.连苯三酚碱性溶液 乙.浓硫酸 丙.醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案____________ 。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200mL1.00mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。(图中夹持装置略)

(4)三颈瓶中发生的化学反应方程式为____________________________ 。
(5)装置中2的作用为__________________________________________ 。
(6)用1.00mol/LNaOH标准溶液滴定过剩的HCl时所选指示剂为_________ (填字母)。
a.石蕊试液 b.酚酞试液 c.甲基橙
(7)产品纯度为____________________ 。
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏高的是_________ (填字母)。
a.滴定时未用NaOH标准溶液润洗滴定管
b.读数时,滴定前平视,滴定后俯视
c.摇动锥形瓶时有液体溅出
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。

Ⅰ.氮化锶的制取
(1)装置B仪器的名称是
(2)装置C、D、E盛装的试剂分别是
甲.连苯三酚碱性溶液 乙.浓硫酸 丙.醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200mL1.00mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。(图中夹持装置略)

(4)三颈瓶中发生的化学反应方程式为
(5)装置中2的作用为
(6)用1.00mol/LNaOH标准溶液滴定过剩的HCl时所选指示剂为
a.石蕊试液 b.酚酞试液 c.甲基橙
(7)产品纯度为
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏高的是
a.滴定时未用NaOH标准溶液润洗滴定管
b.读数时,滴定前平视,滴定后俯视
c.摇动锥形瓶时有液体溅出
您最近一年使用:0次
名校
解题方法
10 . 下列操作能达到相应实验目的的是
| 选项 | 试验目的 | 操作 |
| A | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| B | 测定“84”消毒液的pH | 用洁净的玻璃棒蘸取少量“84”消毒液滴在pH试纸上 |
| C | 验证铁的吸氧腐蚀 | 将未生锈的铁钉放入试管中,用稀硫酸浸没 |
| D | 比较H2C2O4与H2CO3的酸性强弱 | 在H2C2O4溶液中滴加Na2CO3溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-04更新
|
477次组卷
|
4卷引用:广东省2021届高三“六校联盟”第三次联考化学试题



