1 . 将6.0 g镁铝铜混合物加入100 mL盐酸中,充分反应后过滤,并向滤液中滴加2.0 mol·L-1NaOH溶液,测得产生沉淀质量与所加NaOH溶液体积的关系如图所示。有关分析正确的是
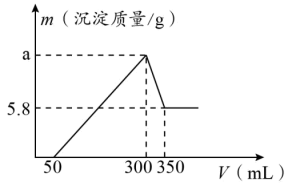

| A.混合物中含有0.01 mol Cu |
| B.图中a=13.6 |
| C.所用盐酸浓度为6.0 mol·L-1 |
| D.与盐酸反应时产生了5.6 L H2 |
您最近一年使用:0次
名校
2 . 在标准状况下,将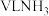 完全溶于1L水,所得溶液的密度为
完全溶于1L水,所得溶液的密度为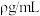 ,溶质质量分数为w,物质的量浓度为
,溶质质量分数为w,物质的量浓度为 ,下列叙述正确的是
,下列叙述正确的是
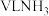 完全溶于1L水,所得溶液的密度为
完全溶于1L水,所得溶液的密度为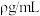 ,溶质质量分数为w,物质的量浓度为
,溶质质量分数为w,物质的量浓度为 ,下列叙述正确的是
,下列叙述正确的是A.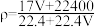 |
B.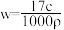 |
C.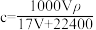 |
D.向上述溶液中加入相同体积的水,所得溶液的溶质质量分数大于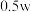 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法不正确的是
| A.2.3gNa投入97.7g 水中所得溶液的质量分数为4% |
| B.62gNa2O与78gNa2O2投入相同体积的足量水中,所得溶液的质量分数不相同 |
| C.78gNa2O2与足量CO2或H2O充分反应,二者生成的O2均为16g |
| D.将28gCO充分燃烧生成的CO2完全通入足量Na2O2中完全反应,固体增28g |
您最近一年使用:0次
2021-11-30更新
|
243次组卷
|
3卷引用:湖南省长沙市雅礼中学2021-2022学年高一上学期期中考试化学试题
4 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.8g CuO与足量 充分反应生成Cu,该反应转移的电子数为0.2 充分反应生成Cu,该反应转移的电子数为0.2 |
B.氢氧燃料电池负极消耗22.4L气体时,电路中通过的电子数目为2 |
C. 与足量镁粉反应转移电子的数目为0.2 与足量镁粉反应转移电子的数目为0.2 |
D.常温常压下, 与水反应转移电子数为 与水反应转移电子数为 |
您最近一年使用:0次
2021-11-21更新
|
163次组卷
|
2卷引用:湖南师范大学附属中学2021-2022学年高三上学期月考试卷(二)化学试题
名校
解题方法
5 . 下列有关溶液浓度的说法正确的是
A.实验室需要450 mL 0.2  的NaOH溶液,应准确称量烧碱3.6 g 的NaOH溶液,应准确称量烧碱3.6 g |
B.将10 mL 18.4  浓硫酸与90 mL水混合,得到的稀硫酸浓度为1.84 浓硫酸与90 mL水混合,得到的稀硫酸浓度为1.84  |
C.配制1   溶液100 mL,应称取明矾晶体47.4 g 溶液100 mL,应称取明矾晶体47.4 g |
D.将500 mL 1  的硝酸溶液蒸发至100 mL,浓度变为5 的硝酸溶液蒸发至100 mL,浓度变为5  |
您最近一年使用:0次
2021-11-12更新
|
241次组卷
|
2卷引用:湖南省衡阳市第八中学2021-2022学年高一上学期期中考试化学试题
名校
6 . 向100 mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。忽略溶液体积的变化,下列说法错误的是
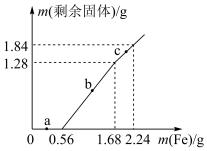

| A.a点时溶液中的阳离子为Cu2+、Fe2+和Fe3+ |
| B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+ |
| C.c点时溶液中溶质的物质的量浓度为0.3 mol·L-1 |
| D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1:1 |
您最近一年使用:0次
2021-11-09更新
|
748次组卷
|
3卷引用:湖南长沙麓山国际实验中学2022-2023学年高一上学期期末线上化学试题
名校
解题方法
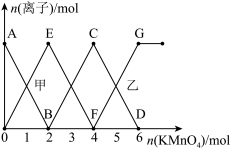
7 . 已知反应:①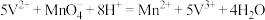
②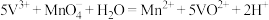
③
现向5L, 的溶液中不断加入一定浓度的酸性
的溶液中不断加入一定浓度的酸性 溶液,溶液中某些离子的物质的量变化如图所示,下列说法不正确的是
溶液,溶液中某些离子的物质的量变化如图所示,下列说法不正确的是
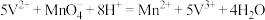
②
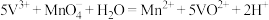
③

现向5L,
 的溶液中不断加入一定浓度的酸性
的溶液中不断加入一定浓度的酸性 溶液,溶液中某些离子的物质的量变化如图所示,下列说法不正确的是
溶液,溶液中某些离子的物质的量变化如图所示,下列说法不正确的是
A. 段对应的离子为 段对应的离子为 |
B. 段、 段、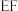 段分别对应反应②、反应③ 段分别对应反应②、反应③ |
C.原溶液中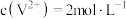 |
D.乙点时: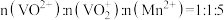 |
您最近一年使用:0次
2021-11-07更新
|
787次组卷
|
5卷引用:湖南省宁远县第一中学2021-2022学年高三上学期11月期中考试化学试题
湖南省宁远县第一中学2021-2022学年高三上学期11月期中考试化学试题(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)河北省石家庄市第十七中学2021-2022学年高二下学期期末考试化学试题(已下线)专题08 氧化还原反应方程式的书写及计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考通用)(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
8 . 某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案一:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案二:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
方案一:铜铝混合物
 测定生成气体的体积
测定生成气体的体积方案二:铜铝混合物
 测定剩余固体的质量
测定剩余固体的质量下列有关判断中不正确的是
| A.溶液A和溶液B均可以是NaOH溶液或稀硝酸 |
| B.若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| C.方案一可能产生氢气,方案二可能剩余铜 |
| D.实验室中方案二更便于实施 |
您最近一年使用:0次
2021-09-27更新
|
406次组卷
|
2卷引用:湖南省湘潭市2022届高三第一模拟考试化学试题
名校
9 . 一个容积为V的密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图所示位置(保持温度不变)。下列说法正确的是
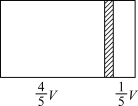

| A.右边与左边分子数之比为4:1 |
| B.右侧CO的质量为7g |
| C.右侧气体密度是相同条件下氢气密度的14倍 |
| D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO |
您最近一年使用:0次
2021-08-19更新
|
504次组卷
|
2卷引用:湖南省长沙市长郡中学2021届高三上学期第一次月考化学试题
名校
解题方法
10 . 如图是某硫酸试剂瓶标签上的部分内容。用该硫酸试剂配制50.0mL4.6mol•L-1的稀硫酸,下列说法不正确的是
| 硫酸化学纯(CP) (500mL) 化学式:H2SO4 相对分子质量:98 质量分数:98% 密度:1.84g/mL |
| A.该硫酸试剂的物质的量浓度为18.4mol•L-1 |
| B.配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL |
| C.配成的9.2mol•L-1的稀硫酸中溶质的质量分数小于49% |
| D.定容时俯视刻度线,所配稀硫酸的浓度会偏低 |
您最近一年使用:0次



