名校
1 . 按要求填空
(1)浓硫酸具有如下的性质: A.酸性B.强氧化性C.吸水性D.脱水性,E难挥发性。下列事实主要表现浓硫酸的什么性质(填字母序号)。
①浓硫酸使蔗糖变黑___________ ;
②碳投入热的浓硫酸中溶解___________ ;
③浓硫酸与氧化铜反应___________ ;
④浓硫酸干燥氢气___________ 。
(2)浓硝酸具有如下的性质:A.酸性B.强氧化性C.不稳定性,下列事实主要表现浓硝酸的什么性质(填字母序号)。
①浓硝酸需避光保存___________ ;
②常温下可用铝或者铁遇浓硝酸钝化___________ 。
(3)二氧化硫气体在下列反应中表现的性质填写在横线上(填字母序号)。
A氧化性 B.漂白性 C.还原性 D.酸性氧化物的性质
①SO2+2OH= +H2O
+H2O___________ ;
②SO2+2H2S=3S↓+2H2O___________ ;
③SO2+Ca(OH)2=CaSO3↓+H2O___________ ;
④SO2+Cl2+2H2O=2HCl+H2SO4___________ 。
(4)氮元素是地球大气中含量最多的元素,请完成下列有关问题:
①写出氮元素的原子结构示意图:___________ 。
②通常情况下,氮气性质不活泼,其原因是___________ 。
A氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
③N2的电子式:___________ 。
④氨是一种重要的化工原料,请写出工业合成氨的化学方程式:___________ 。
⑤检验NH3的方法是___________ 。
(1)浓硫酸具有如下的性质: A.酸性B.强氧化性C.吸水性D.脱水性,E难挥发性。下列事实主要表现浓硫酸的什么性质(填字母序号)。
①浓硫酸使蔗糖变黑
②碳投入热的浓硫酸中溶解
③浓硫酸与氧化铜反应
④浓硫酸干燥氢气
(2)浓硝酸具有如下的性质:A.酸性B.强氧化性C.不稳定性,下列事实主要表现浓硝酸的什么性质(填字母序号)。
①浓硝酸需避光保存
②常温下可用铝或者铁遇浓硝酸钝化
(3)二氧化硫气体在下列反应中表现的性质填写在横线上(填字母序号)。
A氧化性 B.漂白性 C.还原性 D.酸性氧化物的性质
①SO2+2OH=
 +H2O
+H2O②SO2+2H2S=3S↓+2H2O
③SO2+Ca(OH)2=CaSO3↓+H2O
④SO2+Cl2+2H2O=2HCl+H2SO4
(4)氮元素是地球大气中含量最多的元素,请完成下列有关问题:
①写出氮元素的原子结构示意图:
②通常情况下,氮气性质不活泼,其原因是
A氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
③N2的电子式:
④氨是一种重要的化工原料,请写出工业合成氨的化学方程式:
⑤检验NH3的方法是
您最近一年使用:0次
名校
解题方法
2 . 原子是肉眼和一般仪器都看不到的微粒,科学家们是根据可观察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1)下列说法中正确的个数是___________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ 。___________ 光谱(选填“发射”或“吸收”)。
(4)镍铬钢抗腐蚀性能强,基态铬原子的价层电子排布式为___________ 。
(5)已知维生素C的一种同分异构体结构简式如图,则该分子中碳原子的轨道杂化类型为___________ ;分子中有___________ 个σ键和___________ 个π键。
(1)下列说法中正确的个数是___________。
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式: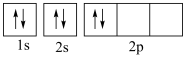
⑦用电子式表示 的形成过程:
的形成过程: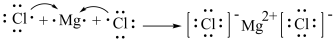
⑧基态钒原子的结构示意图为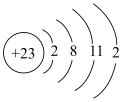
| A.2 | B.3 | C.4 | D.5 |
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.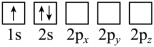 B.
B.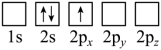
C. 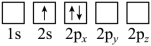 D.
D.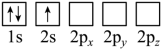
(4)镍铬钢抗腐蚀性能强,基态铬原子的价层电子排布式为
(5)已知维生素C的一种同分异构体结构简式如图,则该分子中碳原子的轨道杂化类型为
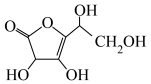
您最近一年使用:0次
解题方法
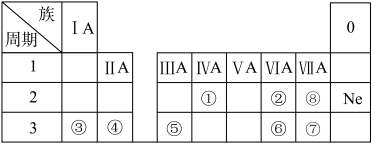
3 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
①___________ ;⑤___________ ;⑦___________ ;⑧___________ 。
(2)②和③元素所组成的化合物中可做供氧剂的是___________ (写化学式)。
(3)⑥元素的原子结构示意图为___________ 。②元素的原子结构示意图为___________ 。
(4)①元素的氧化物中是酸性氧化物的是___________ (写化学式)。
①
(2)②和③元素所组成的化合物中可做供氧剂的是
(3)⑥元素的原子结构示意图为
(4)①元素的氧化物中是酸性氧化物的是
您最近一年使用:0次
名校
解题方法
4 . 下表列出了①~⑩十种元素在周期表中的位置:
请按要求回答下列问题:
(1)上述元素中,金属性最强的是___________ (填元素名称),最高价氧化物对应水化物酸性最强的是___________ (写出酸的化学式)。
(2)由元素③形成的单质的电子式为___________ ,由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程___________ 。
(3)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为___________ 。
(4)可以比较⑤、⑥两元素金属性强弱的实验是___________。
| 族周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ | |||||||
(1)上述元素中,金属性最强的是
(2)由元素③形成的单质的电子式为
(3)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为
(4)可以比较⑤、⑥两元素金属性强弱的实验是___________。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将这两种元素的单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
您最近一年使用:0次
解题方法
5 . 元素周期表反映了元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分。回答下列问题:
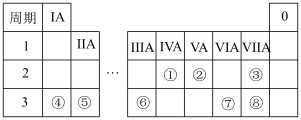
(1)上述元素①~⑧的非金属性最强的是______ (填元素符号);简单离子半径最大的是______ (填离子符号)。
(2)若元素④与⑧形成的化合物为X,用电子式表示X的形成过程:________ ;画出X中阴离子的离子结构示意图:________ 。
(3)⑦⑧两种元素的最高价氧化物的水化物酸性强弱为________ (用化学式表示)。
(4)⑥的单质与强碱反应的离子方程式为_________ 。
(5)已知⑤的单质与①的最高价氧化物Y在点燃条件下能反应生成黑色单质,推测④的单质_____ (填“能”或“不能”)与Y发生类似反应。
(6)已知铷(Rb)是37号元素,与④同主族。下列说法正确的是_______ (填字母)。
a.铷在周期表中的位置为第四周期第ⅠA族
b.铷的熔点比④对应单质的熔点低
c.⑥的简单离子与过量的RbOH反应最终会产生白色沉淀
d.RbOH的碱性比④的最高价氧化物的水化物强

(1)上述元素①~⑧的非金属性最强的是
(2)若元素④与⑧形成的化合物为X,用电子式表示X的形成过程:
(3)⑦⑧两种元素的最高价氧化物的水化物酸性强弱为
(4)⑥的单质与强碱反应的离子方程式为
(5)已知⑤的单质与①的最高价氧化物Y在点燃条件下能反应生成黑色单质,推测④的单质
(6)已知铷(Rb)是37号元素,与④同主族。下列说法正确的是
a.铷在周期表中的位置为第四周期第ⅠA族
b.铷的熔点比④对应单质的熔点低
c.⑥的简单离子与过量的RbOH反应最终会产生白色沉淀
d.RbOH的碱性比④的最高价氧化物的水化物强
您最近一年使用:0次
名校
解题方法
6 . 砷及其化合物用途非常广泛。回答下列问题:
(1)已知:砷(As)与磷位于同一主族相邻位置。画出砷的原子结构示意图:___________ 。
(2) (亚砷酸)是三元弱酸,第一步和第二步电离是通过和水中的氢氧根结合实现的,第三步则直接电离出
(亚砷酸)是三元弱酸,第一步和第二步电离是通过和水中的氢氧根结合实现的,第三步则直接电离出 。第一步电离方程式为
。第一步电离方程式为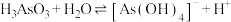 ,第二步的电离方程式为
,第二步的电离方程式为___________ 。
(3)古代《本草衍义》提纯砒霜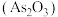 作如下叙述:“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结,累然下垂如乳尖……”,该提纯用的基本操作是
作如下叙述:“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结,累然下垂如乳尖……”,该提纯用的基本操作是___________ 。砷黄铁矿(FeAsS)制烧可生成砒霜和红棕色固体,该反应的化学方程式为___________ 。
(4)处理含砷废水的方法很多,在含高浓度 的酸性溶液中加入
的酸性溶液中加入 可将
可将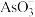 转化为
转化为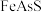 而脱除,该脱除砷的离子方程式为
而脱除,该脱除砷的离子方程式为___________ 。
(1)已知:砷(As)与磷位于同一主族相邻位置。画出砷的原子结构示意图:
(2)
 (亚砷酸)是三元弱酸,第一步和第二步电离是通过和水中的氢氧根结合实现的,第三步则直接电离出
(亚砷酸)是三元弱酸,第一步和第二步电离是通过和水中的氢氧根结合实现的,第三步则直接电离出 。第一步电离方程式为
。第一步电离方程式为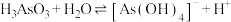 ,第二步的电离方程式为
,第二步的电离方程式为(3)古代《本草衍义》提纯砒霜
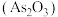 作如下叙述:“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结,累然下垂如乳尖……”,该提纯用的基本操作是
作如下叙述:“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结,累然下垂如乳尖……”,该提纯用的基本操作是(4)处理含砷废水的方法很多,在含高浓度
 的酸性溶液中加入
的酸性溶液中加入 可将
可将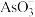 转化为
转化为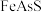 而脱除,该脱除砷的离子方程式为
而脱除,该脱除砷的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)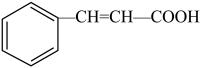 中的官能团名称是
中的官能团名称是_______ 、_______ 。
(2)羟基的电子式_______ 。
(3)烷烃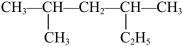 的系统命名是
的系统命名是_______ 。
(4)某烷烃C7H16,主链上有5个碳原子的同分异构体有_______ 种。
(1)
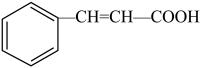 中的官能团名称是
中的官能团名称是(2)羟基的电子式
(3)烷烃
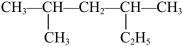 的系统命名是
的系统命名是(4)某烷烃C7H16,主链上有5个碳原子的同分异构体有
您最近一年使用:0次
名校
8 . 表示有机物结构的方法有球棍模型、键线式等。
(1)某化工厂生产的某有机物只含碳、氢、氧三种元素,其分子球棍模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。

①有机物 中表示的原子为
中表示的原子为____________ (用元素符号表示,下同), 表示的原子为
表示的原子为____________ 。
②该有机物的结构简式为________________________ 。
(2)如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。

①有机物“doggycene”的分子式为____________ 。
②该物质完全燃烧,生成 和
和 的物质的量之比为
的物质的量之比为____________ ;0.5mol该物质在足量氧气中完全燃烧生成 和
和 ,消耗氧气的物质的量为
,消耗氧气的物质的量为____________ mol。
③有关有机物“doggycene”的说法正确的是____________ (填字母)。
A.该物质为苯的同系物
B.该物质能发生加成反应
C.该物质在常温下为气态
(1)某化工厂生产的某有机物只含碳、氢、氧三种元素,其分子球棍模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。

①有机物
 中表示的原子为
中表示的原子为 表示的原子为
表示的原子为②该有机物的结构简式为
(2)如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。

①有机物“doggycene”的分子式为
②该物质完全燃烧,生成
 和
和 的物质的量之比为
的物质的量之比为 和
和 ,消耗氧气的物质的量为
,消耗氧气的物质的量为③有关有机物“doggycene”的说法正确的是
A.该物质为苯的同系物
B.该物质能发生加成反应
C.该物质在常温下为气态
您最近一年使用:0次
2023-05-13更新
|
50次组卷
|
2卷引用:黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期5月期中考试化学试题
名校
9 . 下表显示了元素周期表中的一部分。
请回答下列问题。
(1)硫元素的原子序数是_______ 。
(2)氟元素的原子结构示意图为_______ (填写字母)。
A. B.
B.
(3)镁元素在元素周期表的第_______ (填“二”或“三”)周期第_______ (填“ⅡA”或“ⅢA”)族。
(4)已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H_______ (填“<”或“>”)Na。
(5)雷雨天闪电时空气中有O3生成,O2转化为O3是_______ (填“物理变化”或“化学变化”)。
(6)SiO2可用于生产光导纤维,SiO2中硅元素的化合价为_______ 。
(7)海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第一周期 | 1 H 氢 | 2 He 氦 | ||||||
| 第二周期 | 3 Li 锂 | 4 Be 镀 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
| 第三周期1 | 1 Na 钠 | 12 Mg 镁 | 33 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 C 氯 | 18 Ar 氩 |
(1)硫元素的原子序数是
(2)氟元素的原子结构示意图为
A.
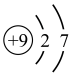 B.
B.
(3)镁元素在元素周期表的第
(4)已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H
(5)雷雨天闪电时空气中有O3生成,O2转化为O3是
(6)SiO2可用于生产光导纤维,SiO2中硅元素的化合价为
(7)海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为
您最近一年使用:0次
2023-05-11更新
|
150次组卷
|
2卷引用:2023年黑龙江省春季普通高中学业合格考试化学试题
名校
解题方法
10 . 按要求回答下列问题:
(1)①基态原子的N层有1个未成对电子,M层未成对电子数最多的元素的价电子排布式为_____ 。
②最外层电子数是次外层电子数3倍的元素的轨道表示式为_____ 。
③Cu原子的结构示意图为_____ 。
(2)N原子核外有_____ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_____ 。
(3)某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的_____ 区。
(1)①基态原子的N层有1个未成对电子,M层未成对电子数最多的元素的价电子排布式为
②最外层电子数是次外层电子数3倍的元素的轨道表示式为
③Cu原子的结构示意图为
(2)N原子核外有
(3)某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的
您最近一年使用:0次



