1 . 国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查,这些食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂,用于食品生产中,丰富舌尖上的营养和美味。氧、硫、硒为同一主族元素,请回答下列问题:
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为___________ 。工业上用浓H2SO4焙烧CuSe的方法提取硒(其中Cu转化为CuSO4),且有SO2、H2O和SeO2(固体)生成,写出发生反应的化学方程式:___________ 。理论上该反应每转移1mol电子,得到的SeO2的质量为___________ 。
(2)下列说法正确的是___________。
(3)短周期元素d.e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
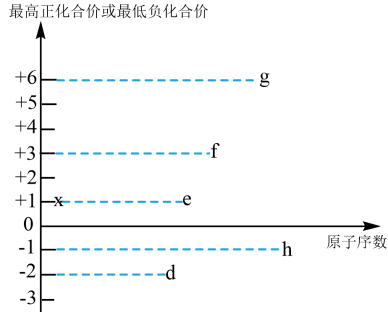
①由x、h、d三种元素组成的化合物的电子式为___________ 。
②D.e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为___________ 。
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为___________ 。
④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程___________ 。
(4)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol•L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:产生的气体的物质的量为___________ mol。若忽略反应前后溶液体积变化,则最终所得溶液中溶质的物质的量浓度为___________ mol•L-1.若要将溶液中的铁元素全部转化为Fe3+,至少需要标准状况下Cl2的体积为___________ L。
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为
(2)下列说法正确的是___________。
A.热稳定性: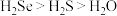 | B.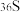 与 与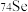 的中子数之和为60 的中子数之和为60 |
C.酸性: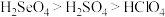 | D.还原性:Se2- < S2- |

①由x、h、d三种元素组成的化合物的电子式为
②D.e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程
(4)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol•L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:产生的气体的物质的量为
您最近一年使用:0次
2024-01-05更新
|
536次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高一上学期12月考试化学试卷
解题方法
2 . 下表列出了A~R9种元素在周期表中的位置:
请回答下列问题。
(1)这些元素分别为:A___________ ,B___________ ,C___________ ,D___________ ,E___________ ,F___________ ,G___________ ,R___________ ,其中化学性质最不活泼的是___________ (用元素符号表示)。
(2)画出G的原子结构示意图___________ 。
(3)元素周期表共有___________ 个周期___________ 个族,18纵行元素化合价通常表现为___________ 价所以称为0族元素,又叫惰性气体元素。A位于___________ 周期___________ 族
(4)H元素与A元素形成的化合物高温灼烧时,火焰呈___________ 色。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H | ||||||
(1)这些元素分别为:A
(2)画出G的原子结构示意图
(3)元素周期表共有
(4)H元素与A元素形成的化合物高温灼烧时,火焰呈
您最近一年使用:0次
2024-01-05更新
|
150次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高一上学期12月考试化学试卷
解题方法
3 . I.完成下列填空:
(1)有机化合物中,碳原子之间可以形成___________ 或碳环。某有机物的结构简式如图,则该有机物___________ (填“属于”或“不属于”)烷烃。
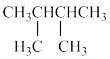
(2)观察下面几种烷烃的球棍模型:

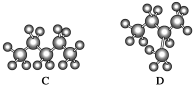
①A的结构简式为___________ ,B的最简式为___________ 。
②C的名称为___________ ,D的分子式为___________ 。
Ⅱ.回答下列问题:
(3)相对分子质量为72的链状烷烃的分子式为___________ ,其同分异构体有___________ 种,其中一氯代物有4种的该烃的结构简式为___________ 。
(4)一种有机物Y的键线式如图所示:
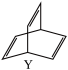
Y的分子式为___________ ;Y的一氯代物有___________ 种。
(1)有机化合物中,碳原子之间可以形成
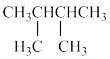
(2)观察下面几种烷烃的球棍模型:


①A的结构简式为
②C的名称为
Ⅱ.回答下列问题:
(3)相对分子质量为72的链状烷烃的分子式为
(4)一种有机物Y的键线式如图所示:

Y的分子式为
您最近一年使用:0次
2023-12-19更新
|
362次组卷
|
2卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期9月考试化学试卷
4 . 下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(1)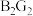 的电子式为
的电子式为___________ 。
(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是___________ (填化学式)。
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为___________ (填化学式)。
(5)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:___________ 。
| A | |||||||||||||||||
| G | I | ||||||||||||||||
| B | E | F | H | ||||||||||||||
| C | D | J |
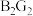 的电子式为
的电子式为(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为
(5)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:
您最近一年使用:0次
解题方法
5 . 粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量较多的SiO2。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反应方程式:Al6Si2O13+3Na2CO3=2NaAlSiO4+4NaAlO2+3CO2↑,结合上述反应完成填空:
(1)Na2CO3中所含化学键的类型是______ ,SiO2属于______ 晶体。
(2)在上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是______ 。
(3)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为______ 。(用元素符号表示)。
(4)二氧化碳分子的结构式为_______ 。
(5)上述元素中有两种元素位于同一主族,可以作为判断两者非金属性强弱的依据的是_____ (填编号)。
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度
(1)Na2CO3中所含化学键的类型是
(2)在上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是
(3)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为
(4)二氧化碳分子的结构式为
(5)上述元素中有两种元素位于同一主族,可以作为判断两者非金属性强弱的依据的是
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度
您最近一年使用:0次
名校
解题方法
6 . 元素在周期表中的位置反映了元素的原子结构和性质。下图是元素周期表的一部分,请按要求回答下列问题:
(1)元素①在元素周期表的位置:第_______ 周期第_______ 族,它是形成化合物种类最多的元素。
(2)写出②的元素符号_______ 。
(3)画出元素④的原子结构示意图_______ 。
(4)元素③和⑤的最高价氧化物对应的水化物中碱性较强的是_______ (填化学式)。
(5)比较⑦和⑧的原子半径大小_______ >_______ (填原子符号)。
(6)元素⑧的单质是一种_______ 色、有刺激性气味的气体。
(7)写出元素⑧的单质与水反应的化学方程式:_______ 。
(8)写出实验室制取元素⑧的单质的离子方程式:_______ 。
族 周期 | IA | 0 | |||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(2)写出②的元素符号
(3)画出元素④的原子结构示意图
(4)元素③和⑤的最高价氧化物对应的水化物中碱性较强的是
(5)比较⑦和⑧的原子半径大小
(6)元素⑧的单质是一种
(7)写出元素⑧的单质与水反应的化学方程式:
(8)写出实验室制取元素⑧的单质的离子方程式:
您最近一年使用:0次
7 . 如表是元素周期表的一部分。回答下列问题:
(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①该表中溴在元素周期表中的位置为____________ 。
②该表中最高价氧化物对应的水化物酸性最强的是______ (填化学式),该元素形成化合物HXO的结构式为______ (X用对应元素符号表示)。
③卤素互化物(如IBr)与卤素单质性质相似。已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式____________ ,IBr中含有的化学键是______ (填“离子键”、“极性键”或“非极性键”)。
(2) 溶于水形成
溶于水形成 溶液,向所得溶液中通入
溶液,向所得溶液中通入 气体,反应生成Se和
气体,反应生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式____________ 。
(3)已知某主族元素离子结构示意图为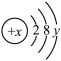 ,其中
,其中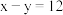 ,此元素与氯元素组成化合物的电子式为
,此元素与氯元素组成化合物的电子式为______ 。
16 S 硫 32.06 | 17 Cl 氯 35.45 |
34 Se 硒 78.96 | 35 Br 溴 79.90 |
53 I 碘 126.9 |
(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①该表中溴在元素周期表中的位置为
②该表中最高价氧化物对应的水化物酸性最强的是
③卤素互化物(如IBr)与卤素单质性质相似。已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式
(2)
 溶于水形成
溶于水形成 溶液,向所得溶液中通入
溶液,向所得溶液中通入 气体,反应生成Se和
气体,反应生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式(3)已知某主族元素离子结构示意图为
 ,其中
,其中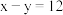 ,此元素与氯元素组成化合物的电子式为
,此元素与氯元素组成化合物的电子式为
您最近一年使用:0次
解题方法
8 . 回答下列问题:
(1) 元素基态原子的最外层有
元素基态原子的最外层有 个未成对电子,次外层有
个未成对电子,次外层有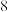 个电子,其元素符号为
个电子,其元素符号为_______ ;其价电子排布图为_______ 。
(2) 元素的负一价离子和
元素的负一价离子和 元素的正一价离子的电子层结构都与氩相同,
元素的正一价离子的电子层结构都与氩相同, 的元素符号为
的元素符号为_______ , 离子的结构示意图为
离子的结构示意图为_______ 。
(3) 元素的正三价离子的
元素的正三价离子的 能级为半充满,
能级为半充满, 的元素符号为
的元素符号为_______ ,其基态原子的电子排布式为_______ ,其原子的结构示意图为_______ 。
(4) 元素基态原子的
元素基态原子的 层全充满,
层全充满, 层没有成对电子且只有一个未成对电子,
层没有成对电子且只有一个未成对电子, 的元素符号为
的元素符号为_______ ,其基态原子的电子排布式为_______ 。
(5) 元素的原子最外层电子排布式为
元素的原子最外层电子排布式为 ,则
,则
_______ ;原子中能量最高的是_______ 电子,核外电子排布图为_______ 。
(1)
 元素基态原子的最外层有
元素基态原子的最外层有 个未成对电子,次外层有
个未成对电子,次外层有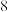 个电子,其元素符号为
个电子,其元素符号为(2)
 元素的负一价离子和
元素的负一价离子和 元素的正一价离子的电子层结构都与氩相同,
元素的正一价离子的电子层结构都与氩相同, 的元素符号为
的元素符号为 离子的结构示意图为
离子的结构示意图为(3)
 元素的正三价离子的
元素的正三价离子的 能级为半充满,
能级为半充满, 的元素符号为
的元素符号为(4)
 元素基态原子的
元素基态原子的 层全充满,
层全充满, 层没有成对电子且只有一个未成对电子,
层没有成对电子且只有一个未成对电子, 的元素符号为
的元素符号为(5)
 元素的原子最外层电子排布式为
元素的原子最外层电子排布式为 ,则
,则
您最近一年使用:0次
解题方法
9 . 如表是元素周期表的一部分。回答下列问题:

(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①该表中溴在元素周期表中的位置为___________ 。
②该表中最高价氧化物对应的水化物酸性最强的是___________ (填化学式),该元素形成化合物HXO的结构式为___________ (X用对应元素符号表示)。
③卤素互化物(如IBr)与卤素单质性质相似。已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式___________ ;IBr中含有的化学键是___________ (填“离子键”、“极性键”或“非极性键”)。
(2) 溶于水形成
溶于水形成 溶液,向所得溶液中通入
溶液,向所得溶液中通入 气体,反应生成Se和
气体,反应生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
(3)已知某主族元素离子结构示意图为 ,其中x-y=12,此元素与氯元素组成化合物的电子式为
,其中x-y=12,此元素与氯元素组成化合物的电子式为___________ 。

(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①该表中溴在元素周期表中的位置为
②该表中最高价氧化物对应的水化物酸性最强的是
③卤素互化物(如IBr)与卤素单质性质相似。已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式
(2)
 溶于水形成
溶于水形成 溶液,向所得溶液中通入
溶液,向所得溶液中通入 气体,反应生成Se和
气体,反应生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式(3)已知某主族元素离子结构示意图为
 ,其中x-y=12,此元素与氯元素组成化合物的电子式为
,其中x-y=12,此元素与氯元素组成化合物的电子式为
您最近一年使用:0次
解题方法
10 . 现有A、B、C、D、E、F六种短周期主族元素,其相关性质信息如下。
请回答下列问题:
(1)元素D在元素周期表中的位置为___________ ,其原子的结构示意图为___________ 。
(2)E和F形成的化合物的电子式为___________ ,该化合物含有的化学键类型是___________ 。
(3)A的简单氢化物,1个分子中含有10个电子,则该氢化物的分子式为___________ 。其稳定性___________ (填“>”、“<”或“=”)D的简单氢化物的稳定性。
(4)B的单质与C的最高价氧化物对应的水化物反应的是离子方程式是___________ 。
(5)下列事实,能证明元素E的非金属性强于S(硫)的非金属性的是___________(选填字母编号)。
| 元素 | 特征 | 元素 | 特征 |
| A | 简单氢化物的分子结构模型为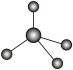 | D | 在地壳中含量最多 |
| B | 第三周期元素,原子最外层电子数为3 | E | 单质为黄绿色的有毒气体 |
| C | 在短周期主族元素中,原子半径最大 | F | 该元素的某种原子不含中子 |
请回答下列问题:
(1)元素D在元素周期表中的位置为
(2)E和F形成的化合物的电子式为
(3)A的简单氢化物,1个分子中含有10个电子,则该氢化物的分子式为
(4)B的单质与C的最高价氧化物对应的水化物反应的是离子方程式是
(5)下列事实,能证明元素E的非金属性强于S(硫)的非金属性的是___________(选填字母编号)。
A.酸性: | B. 通入 通入 溶液能产生黄色沉淀 溶液能产生黄色沉淀 |
C.氢化物稳定性: | D.常温下,E的单质为气态,S的单质为固态 |
您最近一年使用:0次



