解题方法
1 . 人体必需的一些元素在周期表中的分布情况如下:
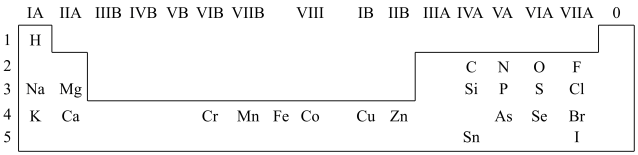
(1)请在上图中画出金属与非金属的分界线______ 。
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为______ 。
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为______ 。
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是______ (填字母)。
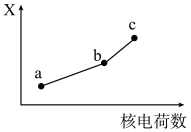
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。
(6)某小组为探究 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验②观察到的现象是______ ,甲同学根据此现象得出结论:氧化性 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是______ 。试从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下,______ ,因此,元素的非金属性逐渐减弱,对应的单质的氧化性逐渐减弱。

(1)请在上图中画出金属与非金属的分界线
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是
| A | B | C | D |
| HCl | H₂O | CO₂ | CH₄ |
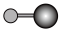 | 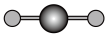 | 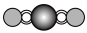 | 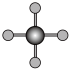 |
| 直线形 | 直线形 | 直线形 | 平面正方形 |
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。

| A.若a、b、c表示碱金属元素,则X表示对应单质的密度 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅥA族元素,则X表示对应氢化物的稳定性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
(6)某小组为探究
 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 |  |  |
| 现象 | 溶液变为黄色 |
 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是
您最近一年使用:0次
名校
2 . 用化学用语表示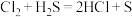 中的相关微粒,其中正确的是
中的相关微粒,其中正确的是
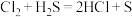 中的相关微粒,其中正确的是
中的相关微粒,其中正确的是A.中子数为1的氢原子: | B. 的结构示意图: 的结构示意图: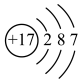 |
C. 中S元素的化合价: 中S元素的化合价: | D.单质S既有氧化性又有还原性 |
您最近一年使用:0次
名校
3 . 根据所学知识,回答问题:
Ⅰ.在第三周期元素及其单质和化合物中,氧化性最强的单质是__________ ,还原性最强的单质是__________ ;最高价氧化物对应的水化物中,最强的酸是__________ ,最强的碱是_________ ,形成的两性氢氧化物是__________ ;化学性质最稳定的元素是__________ 。
Ⅱ.(1)A元素原子的核电荷数为8,其原子核内的质子数为__________ ,该元素原子的二价阴离子的核外电子数为_________ ,中子数是8的核素表示为__________ 。
(2)B元素原子的一价阳离子的核外有10个电子,质量数为23,该元素原子的原子核内中子数为__________ 。
(3)A、B形成1:1型化合物的相对分子质量是__________ 。
Ⅰ.在第三周期元素及其单质和化合物中,氧化性最强的单质是
Ⅱ.(1)A元素原子的核电荷数为8,其原子核内的质子数为
(2)B元素原子的一价阳离子的核外有10个电子,质量数为23,该元素原子的原子核内中子数为
(3)A、B形成1:1型化合物的相对分子质量是
您最近一年使用:0次
解题方法
4 . 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
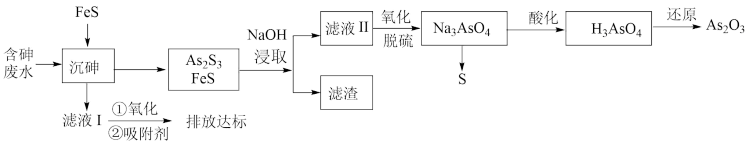
已知:
Ⅰ.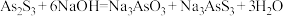
Ⅱ.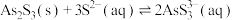
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原
(1) 中砷元素的化合价为
中砷元素的化合价为___________ 价。
(2)“沉砷”过程中FeS是否可以用过量的 替换
替换___________ (填“是”或“否”);请从平衡移动的角度解释原因:___________ 。
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式___________ 。
(4)用 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有___________ 。
(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。
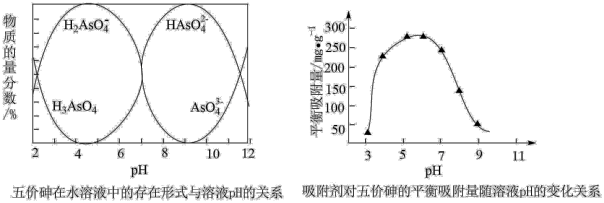
当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因_____ 。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为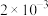 mol/L,则溶液中
mol/L,则溶液中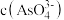 的浓度为
的浓度为_____ mol/L。该处理后的溶液是否符合国家排放标准___________ (填“是”或“否”)。(已知: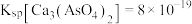 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
 )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
已知:
Ⅰ.
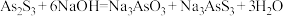
Ⅱ.
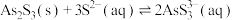
Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原(1)
 中砷元素的化合价为
中砷元素的化合价为(2)“沉砷”过程中FeS是否可以用过量的
 替换
替换(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式
(4)用
 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。

当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为
 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为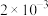 mol/L,则溶液中
mol/L,则溶液中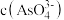 的浓度为
的浓度为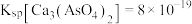 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
您最近一年使用:0次
5 . 可用“沉淀法”除去粗盐中的 、
、 、
、 杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
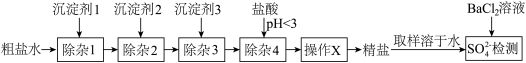
(1)实验1中加入沉淀剂3后会生成_______ (填化学式)。
(2)“除杂4”发生反应的离子方程式有_______ 。
(3)“操作X”为_______ 。
(4)查阅资料:难溶电解质的溶解度会受到溶液中其它离子的影响。加入与难溶电解质相同离子的电解质,因“同离子效应”溶解度降低;加入与难溶电解质不同离子的电解质,因“盐效应”溶解度增大。
①提出假设:
②设计实验:探究不同试剂对硫酸钡溶解度的影响程度
“滤液处理”需用到的试剂有_______ 。
③实验分析:实验3中 溶液的用量为理论值的1.5倍,最后仍检出
溶液的用量为理论值的1.5倍,最后仍检出 的原因是该体系中“同离子效应”
的原因是该体系中“同离子效应”_______ “盐效应”(填“大于”或“小于”)。
④实验结论:粗盐提纯时,为了有效降低产品中 含量,必须
含量,必须_______ 。
 、
、 、
、 杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
| 沉淀剂1 | 沉淀剂1 | 沉淀剂1 | 过滤方式 |  检测结果 检测结果 | |
| 实验1 |  溶液 溶液 | NaOH溶液 |  溶液 溶液 | 逐一过滤 | 少量浑浊 |
| 实验2 |  溶液 溶液 |  溶液 溶液 | NaOH溶液 | 逐一过滤 | 少量浑浊 |
| 实验3 | NaOH溶液 |  溶液 溶液 |  溶液 溶液 | 逐一过滤 | 大量沉淀 |
| 实验4 |  溶液 溶液 | NaOH溶液 |  溶液 溶液 | 一起过滤 | 大量沉淀 |
(2)“除杂4”发生反应的离子方程式有
(3)“操作X”为
(4)查阅资料:难溶电解质的溶解度会受到溶液中其它离子的影响。加入与难溶电解质相同离子的电解质,因“同离子效应”溶解度降低;加入与难溶电解质不同离子的电解质,因“盐效应”溶解度增大。
①提出假设:
| 依据 | 假设 | |
| 假设1 | 实验1和2中 检测时出现少量浑浊 检测时出现少量浑浊 |  溶解度 溶解度 |
| 假设2 | 实验3中 检出量明显高于1和2 检出量明显高于1和2 | NaOH能明显增大 溶解度 溶解度 |
| 假设3 | NaOH或 能明显增大 能明显增大 溶解度 溶解度 |
| 探究1 | 探究2 | 探究3 | 探究4 | |
| 实验流程 | 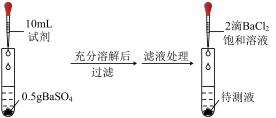 | |||
| 试剂 | 饱和食盐水 | 2 NaOH溶液 NaOH溶液 | 0.5  溶液 溶液 | 蒸馏水 |
| 现象 | 少量浑浊 | 大量沉淀 | 大量沉淀 | 无明显现象 |
③实验分析:实验3中
 溶液的用量为理论值的1.5倍,最后仍检出
溶液的用量为理论值的1.5倍,最后仍检出 的原因是该体系中“同离子效应”
的原因是该体系中“同离子效应”④实验结论:粗盐提纯时,为了有效降低产品中
 含量,必须
含量,必须
您最近一年使用:0次
2022-04-02更新
|
490次组卷
|
2卷引用:福建省八地市(福州、厦门、泉州、莆田、南平、宁德、三明、龙岩)2022届高三毕业班4月诊断性联考化学试题
6 . 下列叙述不正确的是
①Cl-和Cl2的性质相同
②Cl-比Cl多一个电子
③Cl2的氧化性比MnO2的强
④Cl2只有氧化性而没有还原性
①Cl-和Cl2的性质相同
②Cl-比Cl多一个电子
③Cl2的氧化性比MnO2的强
④Cl2只有氧化性而没有还原性
| A.①②④ | B.①② | C.②③④ | D.①③④ |
您最近一年使用:0次
7 . 国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(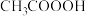 )、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误
)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误
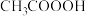 )、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误
)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误| A.氯仿的化学名称是四氧化碳 | B.NaClO通过氧化灭活病毒 |
C. 能与水互溶 能与水互溶 | D.过氧乙酸具有强氧化性 |
您最近一年使用:0次
8 . 完成下列问题
(1)下列化学用语只能用来表示一种微粒的是______
(2)下列叙述中所描述的物质一定是金属元素的是______
(3)下列说法正确的是______
(4)X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族;X、Y、Z三种元素形成的化合物具有强氧化性,其结构如下图所示;。
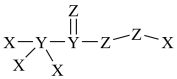
下列叙述错误的是______
(5)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶(SrCO3)是制取锶的原料,用天青石固体(主要成分SrSO4,难溶于水)和Na2CO3溶液混合浸泡可制取碳酸锶。完成下列填空:
①在上述反应体系中出现的几种短周期元素中,原子半径最大的是___________ (填元素符号,下同)。非金属性最强的是___________ 。写出与锶同族第3周期元素原子的结构示意图___________ 。
②反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式___________ 。
③已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号___________ 。下列关于锶及其化合物的叙述中,错误的是___________ 。
a.锶的金属性比镁强 b.氢氢化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
(1)下列化学用语只能用来表示一种微粒的是______
| A.S | B.C2H6O | C.12C | D.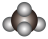 |
(2)下列叙述中所描述的物质一定是金属元素的是______
| A.易失去电子的物质 | B.第三周期中,原子的最外电子层只有2个电子的元素 |
| C.单质具有金属光泽的元素 | D.原子的最外电子层只有1个电子的元素 |
(3)下列说法正确的是______
| A.H2O、H2S、H2Se的分子间作用力依次增大 |
| B.Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物 |
| C.化学键通常指的是相邻的原子或离子之间的强烈的相互作用 |
| D.NaHSO4加热熔化时破坏了该物质中的离子键和共价键 |
(4)X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族;X、Y、Z三种元素形成的化合物具有强氧化性,其结构如下图所示;。
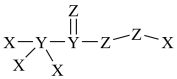
下列叙述错误的是______
| A.该化合物中各元素原子均达稳定结构 |
| B.Z的氢化物的沸点可能高于Y的氢化物 |
| C.Z、W形成的简单离子半径,Z大于W |
| D.由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应 |
(5)锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶(SrCO3)是制取锶的原料,用天青石固体(主要成分SrSO4,难溶于水)和Na2CO3溶液混合浸泡可制取碳酸锶。完成下列填空:
①在上述反应体系中出现的几种短周期元素中,原子半径最大的是
②反应体系中出现的非金属元素可形成二硫化碳(CS2),其分子构型是直线型分子,写出该分子的电子式
③已知:锶的原子序数为38,某锶原子的质量数为88,写出能包含这些信息的一种化学符号
a.锶的金属性比镁强 b.氢氢化锶呈两性
c.锶在化合物中呈+2价 d.锶在自然界中以游离态存在
您最近一年使用:0次
名校
解题方法
9 . 原子结构与化学键
人们运用化学科学,从分子、原子水平上研究了物质及其变化规律。原子结构理论和化学键理论从微观层次揭示了物质的结构。
(1)日本的福岛核废水中含有一种对环境有害的放射性核素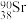 ,关于该核素说法错误是___________。
,关于该核素说法错误是___________。
(2)硒是人体必需的微量元素,如图是元素硒的信息,关于硒元素的说法错误的是___________。

(3)下列性质的比较,不能用元素周期律解释的是___________。
(4)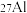 是地壳中最丰富的金属元素,其原子含有中子数为
是地壳中最丰富的金属元素,其原子含有中子数为___________ ,与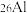 互为
互为___________ 。用化学符号表示铝离子的结构示意图___________ 。A1与 两种微粒在结构上相同的是
两种微粒在结构上相同的是___________ (填选项字母)。
A.质子数 B.核外电子数 C.电子层数 D.最外层电子数
(5)汽车安全气囊中的填充物有 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和
遇撞击时能生成金属钠和 ,气囊的体积迅速膨胀,达到保护驾乘人员的目的。
,气囊的体积迅速膨胀,达到保护驾乘人员的目的。
①写出 的电子式
的电子式___________ 。
② 是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。 晶体中存在的化学键类型是
晶体中存在的化学键类型是___________ 。
③汽车安全气囊填充物的三种物质中属于共价化合物的是___________ (填化学式),所涉及的5种元素中,原子半径最大的是___________ (填元素符号)。
④某品牌汽车的安全气囊中若有13g ,遇撞击时能产生气体
,遇撞击时能产生气体___________ L(标准状况下),转移电子___________ mol。
(6) 、
、 能与金属钠发生反应生成
能与金属钠发生反应生成 ,化学方程式如下所示:
,化学方程式如下所示:
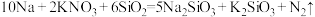
①用单线桥法在上述的化学方程式中标出电子转移的方向和数目___________ 。
②上述反应中氧化剂是___________ (填写化学式,下同),氧化产物是___________ 。
人们运用化学科学,从分子、原子水平上研究了物质及其变化规律。原子结构理论和化学键理论从微观层次揭示了物质的结构。
(1)日本的福岛核废水中含有一种对环境有害的放射性核素
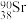 ,关于该核素说法错误是___________。
,关于该核素说法错误是___________。A.与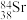 的化学性质几乎相同 的化学性质几乎相同 | B.中子数与质子数之差为52 |
C.与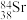 互为同位素 互为同位素 | D.Sr在元素周期表中位于ⅡA族 |

| A.位于ⅥA族 | B.质量数为34 |
| C.位于第四周期 | D.相对原子质量为78.96 |
| A.非金属性:F>O>N |
| B.碱性:KOH>NaOH>LiOH |
C.热稳定性: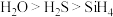 |
D.酸性: |
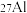 是地壳中最丰富的金属元素,其原子含有中子数为
是地壳中最丰富的金属元素,其原子含有中子数为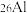 互为
互为 两种微粒在结构上相同的是
两种微粒在结构上相同的是A.质子数 B.核外电子数 C.电子层数 D.最外层电子数
(5)汽车安全气囊中的填充物有
 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和
遇撞击时能生成金属钠和 ,气囊的体积迅速膨胀,达到保护驾乘人员的目的。
,气囊的体积迅速膨胀,达到保护驾乘人员的目的。①写出
 的电子式
的电子式②
 是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1∶1的比例构成的化合物。 晶体中存在的化学键类型是
晶体中存在的化学键类型是③汽车安全气囊填充物的三种物质中属于共价化合物的是
④某品牌汽车的安全气囊中若有13g
 ,遇撞击时能产生气体
,遇撞击时能产生气体(6)
 、
、 能与金属钠发生反应生成
能与金属钠发生反应生成 ,化学方程式如下所示:
,化学方程式如下所示: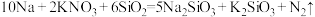
①用单线桥法在上述的化学方程式中标出电子转移的方向和数目
②上述反应中氧化剂是
您最近一年使用:0次
名校
解题方法
10 . I.金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是_________________ 。
(2)GaAs是共价化合物,一种重要的半导体材料。As与Ga同周期,As与N同主族。
①下列事实不能用元素周期律解释的是______________ (填字母)。
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
②废弃含GaAs半导体材料可以用浓硝酸溶解GaAs,生成H3AsO4和Ga3+,写出该反应的化学方程式________________________________ 。
II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(1)C-的电子式:_________________ 。
(2)电子式表示A2B的形成过程_______________________ 。
(3)含F3+的溶液中通入过量D,反应的离子方程式是_______________ 。
(4)A单质与E反应的生成的化合物中化学键的类型是____________________ 。
(1)铝在元素周期表中的位置是
(2)GaAs是共价化合物,一种重要的半导体材料。As与Ga同周期,As与N同主族。
①下列事实不能用元素周期律解释的是
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
②废弃含GaAs半导体材料可以用浓硝酸溶解GaAs,生成H3AsO4和Ga3+,写出该反应的化学方程式
II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(1)C-的电子式:
(2)电子式表示A2B的形成过程
(3)含F3+的溶液中通入过量D,反应的离子方程式是
(4)A单质与E反应的生成的化合物中化学键的类型是
您最近一年使用:0次



