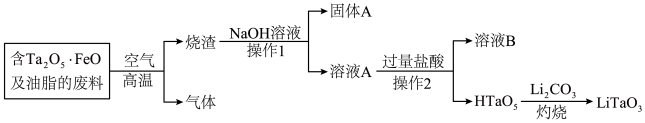
2024·吉林长春·三模
解题方法
1 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将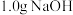 溶于
溶于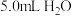 中,添加
中,添加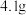 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在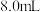 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在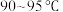 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
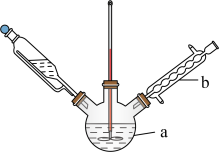
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
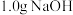 溶于
溶于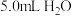 中,添加
中,添加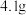 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在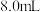 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
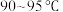 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
23-24高三上·河南驻马店·期末
名校
解题方法
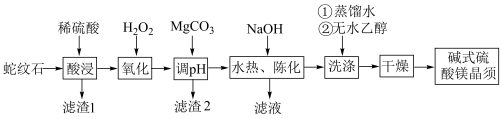
2 . 碱式硫酸镁晶须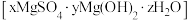 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含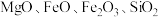 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是_______ 。
(2)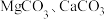 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:_______ 。
(3)洗涤步骤中用无水乙醇洗涤的目的是_______ 。
(4)氧化的目的是_______ (用离子方程式表示),为检验溶液中的离子是否完全被氧化,可使用的试剂为_______ (填化学式)。
(5)将碱式硫酸镁晶须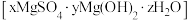 进行热重分析测定其化学式,
进行热重分析测定其化学式,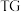 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为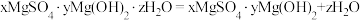 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为_______ ;第二次失重发生反应的化学方程式为_______ 。
②图2中的晶胞参数为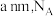 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为_______ ,该晶体的密度为_______  。
。
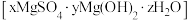 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含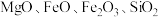 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是
(2)
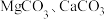 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:(3)洗涤步骤中用无水乙醇洗涤的目的是
(4)氧化的目的是
(5)将碱式硫酸镁晶须
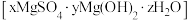 进行热重分析测定其化学式,
进行热重分析测定其化学式,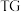 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为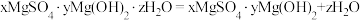 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为
②图2中的晶胞参数为
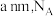 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为 。
。
您最近一年使用:0次
2024-01-22更新
|
261次组卷
|
4卷引用:T28-工业流程题
23-24高一上·河南·阶段练习
名校
解题方法
3 . 聚合硫酸铁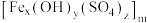 (铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
(铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
①称取一定质量的聚合硫酸铁,配成 溶液。
溶液。
②准确量取①中溶液 于烧杯中,加入足量的盐酸酸化的
于烧杯中,加入足量的盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 。
。
③准确量取①中溶液 于烧杯中,加入足量的
于烧杯中,加入足量的 溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体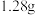 。
。
该聚合硫酸铁组成中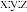 为
为
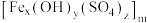 (铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
(铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁,配成
 溶液。
溶液。②准确量取①中溶液
 于烧杯中,加入足量的盐酸酸化的
于烧杯中,加入足量的盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 。
。③准确量取①中溶液
 于烧杯中,加入足量的
于烧杯中,加入足量的 溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体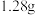 。
。该聚合硫酸铁组成中
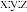 为
为A. | B. | C.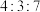 | D. |
您最近一年使用:0次
2023-12-30更新
|
167次组卷
|
3卷引用:选择题11-14
2023·安徽合肥·模拟预测
名校
解题方法
4 . 氧钒(IV)碱式碳酸铵化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O,它是制备热敏材料VO2的原料,已知VO2+在酸性条件下易被氧化,氧钒(IV)碱式碳酸铵的制备流程如图:
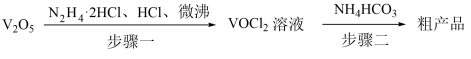
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能_______ ;生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为_______ 。
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→_______ 。
②实验开始时,先关闭K2,打开K1,当_______ 时(写实验现象),再关闭K1,打开K2,充分反应,静置,得到固体。
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
①滴定至反应终点的现象为_______ ;
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为_______ %;
③下列情况会导致产品纯度偏大的是_______ (填标号)。
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
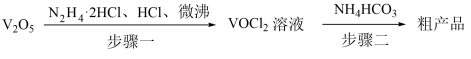
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→
②实验开始时,先关闭K2,打开K1,当
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO
 ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。①滴定至反应终点的现象为
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为
③下列情况会导致产品纯度偏大的是
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
您最近一年使用:0次
2023-06-18更新
|
373次组卷
|
3卷引用:T15-实验探究题
2023·浙江·模拟预测
解题方法
5 . 工业上以铬铁矿(FeCr2O4质量分数为a%,含Al2O3、SiO2等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程图如图,回答下列问题:
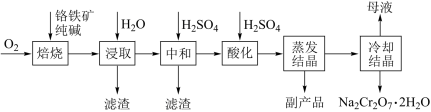
(1)焙烧的目的是将FeCr2O4转化为Na2CrO4,写出转化过程中生成可溶性含铝组分的化学方程式:______ 。
(2)下列有关说法不正确 的是______ 。
(3)蒸发结晶,盛放样品的容器名称是_______ 。
(4)酸化的目的是(结合离子方程式说明)______ 。
(5)利用氧化还原滴定法测定Na2Cr2O7•2H2O产品的纯度,从下列选项中选择合适的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器,“(_______)”内填写一种操作 ,均用字母表示]。用______ (称量产品2.50g)→在烧杯中__________ →用容量瓶__________ →用移液管(取25.00mL所配溶液于锥形瓶中)→加入足量碘化钠溶液→加入3滴淀粉指示剂→用______ (用0.1200mol•L-1Na2S2O3标准溶液滴定)→_________ 并且 内不恢复原来的颜色,消耗标准溶液40.00mL
内不恢复原来的颜色,消耗标准溶液40.00mL
仪器:a.碱式滴定管;b.酸式滴定管;c.电子天平;d.托盘天平;
操作:e.加硫酸溶解;f.加盐酸溶解;g.配制250mL溶液;h.观察到溶液蓝色褪去:i.观察到溶液变成蓝色
(6)若以铬铁矿为原料制备mkg硼化铬(CrB),在工艺流程中Cr损失b%,则至少需要铬铁矿的质量为______ kg(用含字母的计算式表示)。

(1)焙烧的目的是将FeCr2O4转化为Na2CrO4,写出转化过程中生成可溶性含铝组分的化学方程式:
(2)下列有关说法
| A.蒸发结晶时如果长时间蒸发,有利于提高Na2Cr2O7•2H2O的产率 |
| B.除了Na2Cr2O7外,在上述工艺流程中可循环利用的物质还有H2SO4 |
| C.含铁元素的化合物可在中和过程中被除去 |
| D.焙烧时气流与矿料逆流而行,其目的是增大反应物接触面积,提高反应速率 |
(4)酸化的目的是(结合离子方程式说明)
(5)利用氧化还原滴定法测定Na2Cr2O7•2H2O产品的纯度,从下列选项中选择合适的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器,“(_______)”内填写
 内不恢复原来的颜色,消耗标准溶液40.00mL
内不恢复原来的颜色,消耗标准溶液40.00mL仪器:a.碱式滴定管;b.酸式滴定管;c.电子天平;d.托盘天平;
操作:e.加硫酸溶解;f.加盐酸溶解;g.配制250mL溶液;h.观察到溶液蓝色褪去:i.观察到溶液变成蓝色
(6)若以铬铁矿为原料制备mkg硼化铬(CrB),在工艺流程中Cr损失b%,则至少需要铬铁矿的质量为
您最近一年使用:0次
2023·河南·三模
名校
解题方法
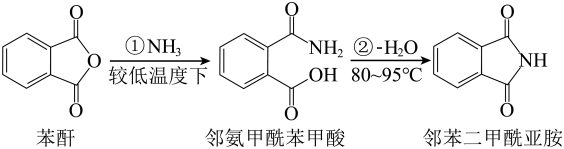
6 . 邻苯二甲酰亚胺广泛用于染料、农药医药橡胶、香料等行业,是许多重要有机精细化学品的中间体。反应原理为
制备邻苯二甲酰亚胺的实验装置如图所示。
向装置甲的三颈烧瓶中加入14.8000g苯酐(相对分子质量为148),然后再加入15.0mL氨水(过量),加热至冷凝管中有部分液体回流时开启搅拌,控制温度为80~95°C,待苯酐固体完全反应后,改为蒸馏装置乙,继续加热,将装置中的水蒸出,体系温度逐渐升高至固体熔化。保温反应60min后,冷却至室温,洗涤、抽滤、烘干,进一步提纯得固体邻苯二甲酰亚胺(相对分子质量为147)14.1120g。
请回答下列问题:
(1)仪器M的名称是___________ 。
(2)仪器Y中冷水由___________ (填“a”或“b”)口流出,装置甲中仪器X一般不用装置乙中仪器Y代替的原因是___________ 。
(3)装置甲中温度控制在80~95°C,若温度过低导致的结果是___________ 。
(4)反应①中除了生成邻氨甲酰苯甲酸,还可能生成的副产物是___________ (写一种物质的结构简式)。
(5)蒸馏时,需要及时将装置中的水蒸出,目的是___________ 。
(6)该固体产品的产率是___________ 。
(7)邻苯二甲酰亚胺还可以用邻二甲苯与氨气、空气在加热条件下催化反应一步制得,写出该反应的化学方程式:___________ 。
| 物质 | 熔点/°C | 沸点/°C | 溶解性 |
| 苯酐 | 131~134 | 284 | 不溶于冷水,微溶于热水 |
| 邻氨甲酰苯甲酸 | 140~143 | 394.2 | 稍溶于热水 |
| 邻苯二甲酰亚胺 | 232~235 | 366 | 微溶于水,易溶于碱溶液 |

向装置甲的三颈烧瓶中加入14.8000g苯酐(相对分子质量为148),然后再加入15.0mL氨水(过量),加热至冷凝管中有部分液体回流时开启搅拌,控制温度为80~95°C,待苯酐固体完全反应后,改为蒸馏装置乙,继续加热,将装置中的水蒸出,体系温度逐渐升高至固体熔化。保温反应60min后,冷却至室温,洗涤、抽滤、烘干,进一步提纯得固体邻苯二甲酰亚胺(相对分子质量为147)14.1120g。
请回答下列问题:
(1)仪器M的名称是
(2)仪器Y中冷水由
(3)装置甲中温度控制在80~95°C,若温度过低导致的结果是
(4)反应①中除了生成邻氨甲酰苯甲酸,还可能生成的副产物是
(5)蒸馏时,需要及时将装置中的水蒸出,目的是
(6)该固体产品的产率是
(7)邻苯二甲酰亚胺还可以用邻二甲苯与氨气、空气在加热条件下催化反应一步制得,写出该反应的化学方程式:
您最近一年使用:0次
2023-04-26更新
|
1337次组卷
|
4卷引用:专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)
(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河南省名校大联考2023届高三下学期三模考试理综化学试题江西省宜春市上高二中2023-2024学年高二下学期3月月考化学试题
22-23高三下·湖北武汉·阶段练习
名校
解题方法
7 . 从烟气脱硝催化剂(含 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。
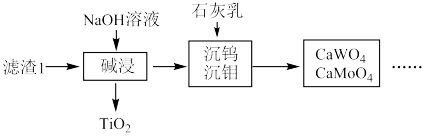
(1)粉碎的目的是_______ ,滤渣1的成分为_______ 。
(2)若酸浸还原产物为 ,其中V的化合价是
,其中V的化合价是_______ 。用 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式_______ 。
(3)写出“富集氧化”过程的化学方程式_______ ,若用 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
_______ mol。
(4)可用 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为_______ %。(保留1位小数)
(5) 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。________ 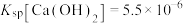 ,
,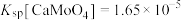 ,且
,且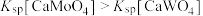 。
。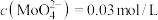 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为_______ 时开始产生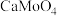 沉淀。
沉淀。
 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。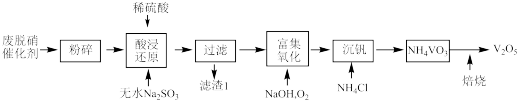
(1)粉碎的目的是
(2)若酸浸还原产物为
 ,其中V的化合价是
,其中V的化合价是 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式(3)写出“富集氧化”过程的化学方程式
 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
(4)可用
 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为(5)
 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。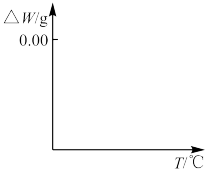
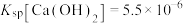 ,
,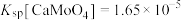 ,且
,且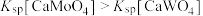 。
。
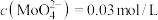 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为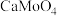 沉淀。
沉淀。
您最近一年使用:0次
2023-02-24更新
|
814次组卷
|
4卷引用:第8讲 物质的量与气体摩尔体积
2022高三·全国·专题练习
8 . 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:
①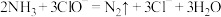
②
在一定条件下模拟处理氨氮废水:将 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与
混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与 投入量(用x表示)的关系如下图所示。下列说法正确的是
投入量(用x表示)的关系如下图所示。下列说法正确的是
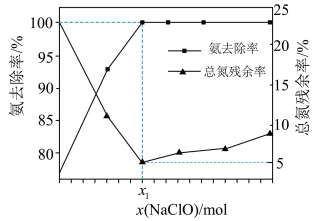
①
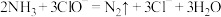
②

在一定条件下模拟处理氨氮废水:将
 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与
混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与 投入量(用x表示)的关系如下图所示。下列说法正确的是
投入量(用x表示)的关系如下图所示。下列说法正确的是
A.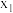 的数值为0.009 的数值为0.009 |
B.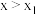 时, 时,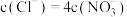 |
C.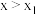 时,x越大,生成 时,x越大,生成 的量越少 的量越少 |
D. 时, 时,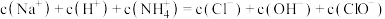 |
您最近一年使用:0次
2023-02-20更新
|
4821次组卷
|
11卷引用:专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编
(已下线)专题09 化学反应速率、化学平衡-2022年高考真题模拟题分项汇编(已下线)2022年福建省高考真题变式题(选择题6-10)(已下线)专题17 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第9讲 物质的量浓度(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2022年福建省高考真题化学试题上海市徐汇区2022-2023学年高三下学期4月学习能力诊断化学试题上海市徐汇区2023届高三二模化学试题天津市第一中学2023-2024学年高二上学期11月期中考试化学试题
2023高三·全国·专题练习
解题方法
9 . 若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4·5H2O的质量分数为_______ (列出算式可能用到的化学式量:CuSO4 160、CuSO4·5H2O 250、Cu(NO3)2·3H2O 242、BaSO4 233)。
您最近一年使用:0次