名校
解题方法
1 . 某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉,A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
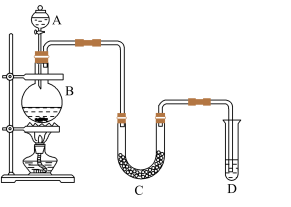
(1)烧瓶B中发生反应的离子方程式_______ ;
(2)在该反应中浓盐酸所体现的性质是:_______ 。(填符号)
a.酸性 b.氧化性 c.还原性 d.碱性 e.易挥发性
(3)漂白粉将在U型管中产生,其化学反应方程式是_______ ,漂白粉的有效成分为_______ (填化学式),写出漂白粉露置在空气中失效过程中所涉及的化学方程式:_______ 、_______ 。
(4)已知 是强酸,
是强酸, 在水中的电离方程式为
在水中的电离方程式为_______ 。

(1)烧瓶B中发生反应的离子方程式
(2)在该反应中浓盐酸所体现的性质是:
a.酸性 b.氧化性 c.还原性 d.碱性 e.易挥发性
(3)漂白粉将在U型管中产生,其化学反应方程式是
(4)已知
 是强酸,
是强酸, 在水中的电离方程式为
在水中的电离方程式为
您最近一年使用:0次
2 . 消毒剂因能杀灭病原微生物、切断传染病的传播途径而在生活中广泛应用。过氧乙酸(一元弱酸)、“84”消毒液、二氧化氯 、
、 、
、 等均是生活中常见消毒剂。
等均是生活中常见消毒剂。
(1)下列消毒剂属于电解质的是_______。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)解释“84”消毒液与洁厕灵(主要成分是盐酸)不能混合使用的原因_______ 。
(4)将氯气转化为液氯的过程中,说法错误的是_______。
(5)氯气与下列物质反应时,氯原子只得到电子的是_______。
(6)下列实验现象的“解释或结论”正确的是_______。
(7)在酸性介质中,次氯酸根与碘离子反应,析出碘。反应如下:
请标出电子转移的方向和数目_______ 。
(8)消毒效率可用单位质量消毒剂的得电子数来表示。计算 的消毒效率约是氯气的
的消毒效率约是氯气的_______ 倍。(保留到小数点后两位)
(9)用固体 通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。
通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。

已知:过程中锰元素最终转化为
 、
、 、
、 等均是生活中常见消毒剂。
等均是生活中常见消毒剂。(1)下列消毒剂属于电解质的是_______。
A. | B.过氧乙酸 | C. | D.“84”消毒液 |
(2)写出
 的电离方程式
的电离方程式(3)解释“84”消毒液与洁厕灵(主要成分是盐酸)不能混合使用的原因
(4)将氯气转化为液氯的过程中,说法错误的是_______。
| A.需要降温或加压 | B.氯分子间的平均距离减小 |
| C.氯分子数目减小 | D.氯分子间的作用力减小 |
(5)氯气与下列物质反应时,氯原子只得到电子的是_______。
| A.Cu | B. | C. | D. |
(6)下列实验现象的“解释或结论”正确的是_______。
| 选项 | 实验现象 | 解释或结论 |
| A | 氯气能使湿润的淀粉KI试纸变蓝:氯气能使 溶液变橙色 溶液变橙色 | 氧化性: |
| B | 氧气能使湿润的蓝色石蕊试纸先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | 氯气通入 的水溶液中,溶液的导电能力增强 的水溶液中,溶液的导电能力增强 | 氯气是强电解质 |
| D | 氧气通入 溶液中,溶液变棕黄色 溶液中,溶液变棕黄色 | 氧化性: |
| A.A | B.B | C.C | D.D |
(7)在酸性介质中,次氯酸根与碘离子反应,析出碘。反应如下:

请标出电子转移的方向和数目
(8)消毒效率可用单位质量消毒剂的得电子数来表示。计算
 的消毒效率约是氯气的
的消毒效率约是氯气的(9)用固体
 通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。
通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。
已知:过程中锰元素最终转化为

| A.G与H均为氧化产物 | B.实验中 只作氧化剂 只作氧化剂 |
| C.实验中浓盐酸体现出酸性和还原性 | D.G与H的物质的量之和可能为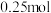 |
您最近一年使用:0次
3 . Ⅰ.氯化钠是日常生活必需品和重要的化工原料。海水中含有大量的NaCl。
(1)下列生产过程中只发生物理变化的是__________。
| A.炼铁 | B.海带提碘 | C.氯碱工业 | D.海水晒盐 |
(2)氯化钠属于__________。
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(3)
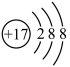 表示__________。
表示__________。| A.氯原子的结构示意图 | B.氯离子的结构示意图 |
| C.氯原子的电子式 | D.氯离子的电子式 |
Ⅱ.实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去 Ca2+、 Mg2+、 等可溶性杂质。
等可溶性杂质。
(4)写出NaCl溶于水时的电离方程式
(5)为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3液,加热至70°C左右约2分钟,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
Ⅲ.“84消毒液”是常见的消毒剂,其有效成分是NaClO。
(6)Cl2和NaOH 制备NaClO的化学方程式为
Ⅳ.如图是某品牌“84 消毒液”的使用注意事项。

(7)注意事项4“易使有色衣物脱色”,是因为 “84 消毒液”具有
A.碱性 B.强氧化性
(8)注意事项6“不可与酸性物质同时使用”,例如,若将“84 消毒液”与“洁厕灵”(含盐酸) 同时使用会产生黄绿色有毒气体。写出反应的离子方程式
您最近一年使用:0次
21-22高一上·上海浦东新·期中
名校
解题方法
4 . 储氢纳米碳管具有广泛的用途,电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒,这种碳钠来颗粒可用氧化气化法提纯,反应的化学方程式如下(未配平):




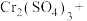

回答下列问题:
(1)配平上述反应方程式,并标出电子转移方向和数目___________ 。
(2) 在该反应中表现出___________(填标号)。
在该反应中表现出___________(填标号)。
(3)生成物中属于非电解质的有___________ 。
磷酸( )、次磷酸(
)、次磷酸( )是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:
)是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:
(4)① 及
及 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。从物质的分类来看,
还原为银,从而可用于化学镀银。从物质的分类来看, 属于
属于___________ (填标号)。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
②写出 与足量NaOH溶液反应的离子方程式
与足量NaOH溶液反应的离子方程式___________ 。
(5)实验室可以用浓磷酸与NaBr(s)加热反应制取HBr气体,利用了浓磷酸的___________ 性,能否用浓硫酸代替浓磷酸制取HBr?说明理由___________ 。





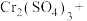

回答下列问题:
(1)配平上述反应方程式,并标出电子转移方向和数目
(2)
 在该反应中表现出___________(填标号)。
在该反应中表现出___________(填标号)。| A.只有酸性 | B.只有氧化性 |
| C.酸性和氧化性 | D.酸性和还原性 |
磷酸(
 )、次磷酸(
)、次磷酸( )是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:
)是精细磷化工产品,均属于中强酸,磷酸为三元酸,而次磷酸为一元酸。回答下列问题:(4)①
 及
及 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。从物质的分类来看,
还原为银,从而可用于化学镀银。从物质的分类来看, 属于
属于a.正盐 b.酸式盐 c.钠盐 d.氧化物
②写出
 与足量NaOH溶液反应的离子方程式
与足量NaOH溶液反应的离子方程式(5)实验室可以用浓磷酸与NaBr(s)加热反应制取HBr气体,利用了浓磷酸的
您最近一年使用:0次
5 . 海水的综合利用主要包括海水直接利用,海水淡化和海水中化学元素的利用等方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。______ 操作。
2.粗盐中存在 、
、 、
、 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)
①过量的 溶液②过量的
溶液②过量的 溶液③过量的NaOH溶液
溶液③过量的NaOH溶液
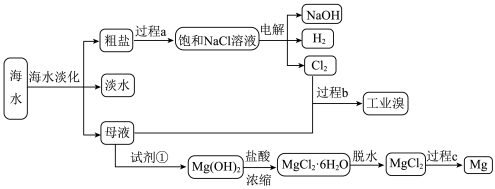
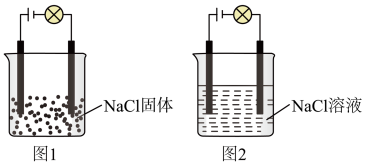
3.某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是______。
4.电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是______。
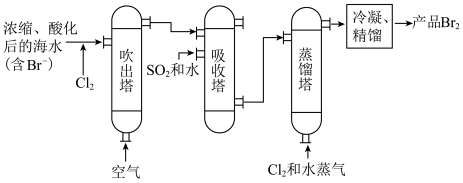
5.过程b用于海水提溴。主要工业生产流程如下图所示。 ,利用了
,利用了 的
的______ ,吸收塔中吸收 ,利用了
,利用了 的
的______ 。
A.氧化性 B.还原性 C.挥发性 D.易溶于水
6.从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式______ 。
②检验阳极产物时可选用______ 。
③实验测得产生的 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为______  。
。
7.实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。______ 、______ 。
2.粗盐中存在
 、
、 、
、 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)①过量的
 溶液②过量的
溶液②过量的 溶液③过量的NaOH溶液
溶液③过量的NaOH溶液| A.①②③ | B.①③② | C.②①③ | D.③②① |
| A.NaCl固体不导电,不电解质 |
| B.电解质本身不一定能导电 |
C.图2中水是电解质,电离产生大量的 和 和 |
| D.图2中NaCl在电流作用下电离出了大量自由移动的离子 |
| A.Ar | B. | C. | D. |
 ,利用了
,利用了 的
的 ,利用了
,利用了 的
的A.氧化性 B.还原性 C.挥发性 D.易溶于水
6.从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物时可选用
③实验测得产生的
 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为 。
。7.实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。
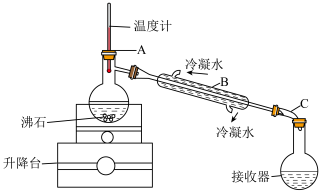
您最近一年使用:0次
名校
6 . 海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。

(1)海水晒盐使用的盐田法,相当于化学中的___________ 操作。
(2)关于海水的综合利用,以下说法正确的是___________ 。
A.从海水中提溴、镁元素,都包含氧化还原反应
B.利用潮汐发电是将电能转化为动能
C.海域辽阔,所以可以将废水排入海洋
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是___________ 。
A. 固体不导电,不是电解质
固体不导电,不是电解质
B.电解质本身不一定能导电
C.图2中水是电解质,电离产生大量的
(4)过程 用于海水提溴。主要工业生产流程如下图所示。
用于海水提溴。主要工业生产流程如下图所示。

①向苦卤中通入 ,利用了
,利用了 的
的___________ ,
②吹出塔中通入热空气吹出 ,利用了
,利用了 的
的___________ 。
A.氧化性 B.还原性
C.挥发性,沸点比水低 D.易溶于水
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式___________ 。
②检验阳极产物的方法为___________ 。
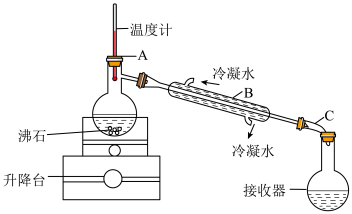
(6)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。该装置中有一处明显的错误是___________ 。

(1)海水晒盐使用的盐田法,相当于化学中的
(2)关于海水的综合利用,以下说法正确的是
A.从海水中提溴、镁元素,都包含氧化还原反应
B.利用潮汐发电是将电能转化为动能
C.海域辽阔,所以可以将废水排入海洋
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是

A.
 固体不导电,不是电解质
固体不导电,不是电解质B.电解质本身不一定能导电
C.图2中水是电解质,电离产生大量的

(4)过程
 用于海水提溴。主要工业生产流程如下图所示。
用于海水提溴。主要工业生产流程如下图所示。
①向苦卤中通入
 ,利用了
,利用了 的
的②吹出塔中通入热空气吹出
 ,利用了
,利用了 的
的A.氧化性 B.还原性
C.挥发性,沸点比水低 D.易溶于水
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物的方法为
(6)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。该装置中有一处明显的错误是

您最近一年使用:0次
名校
解题方法
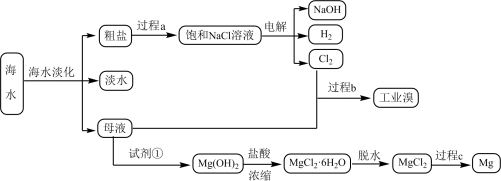
7 . 海水的综合利用。海水的综合利用主要包括海水直接利用,海水淡化和海水中化学元素的利用三个方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。
(1)海水晒盐使用的盐田法,相当于化学中的___________ 操作。
(2)粗盐中存在Ca2+、Mg2+、SO 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。
①过量的Na2CO3溶液 ②过量的BaCl2溶液 ③过量的NaOH溶液
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是___________。

(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是___________。
(5)过程b用于海水提溴。主要工业生产流程如下图所示。
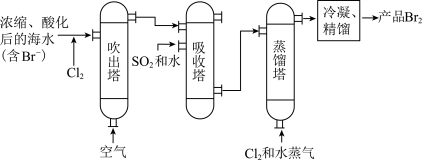
吹出塔中通入热空气吹出Br2,利用了Br2的___________ ,吸收塔中吸收Br2,利用了Br2的___________ 。
A. 氧化性 B. 还原性 C. 挥发性 D. 易溶于水
(6)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式___________ 。
②检验阳极产物时可选用___________ 。
③实验测得产生的H2体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为___________ mol·L-1。
(7)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。
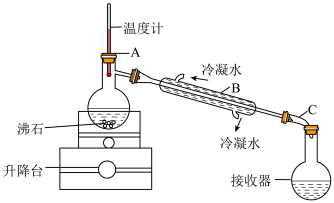
该装置中有一处明显的错误是___________ 。

(1)海水晒盐使用的盐田法,相当于化学中的
(2)粗盐中存在Ca2+、Mg2+、SO
 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。①过量的Na2CO3溶液 ②过量的BaCl2溶液 ③过量的NaOH溶液
| A.①②③ | B.①③② | C.②①③ | D.③①② |

| A.NaCl固体不导电,不是电解质 |
| B.电解质本身不一定能导电 |
| C.图2中水是电解质,电离产生大量的H+和OH- |
| D.图2中NaCl在电流作用下电离出了大量自由移动的离子 |
| A.Ar | B.CO2 | C.N2 | D.O2 |

吹出塔中通入热空气吹出Br2,利用了Br2的
A. 氧化性 B. 还原性 C. 挥发性 D. 易溶于水
(6)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物时可选用
③实验测得产生的H2体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为
(7)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。

该装置中有一处明显的错误是
您最近一年使用:0次
解题方法
8 . Ⅰ. (H-O-O-H)既有氧化性又有还原性,其中氧处于中间价态。完成下列填空:
(H-O-O-H)既有氧化性又有还原性,其中氧处于中间价态。完成下列填空:
(1) 是二元弱酸,则
是二元弱酸,则 的第一步电离方程式为
的第一步电离方程式为_______ 。
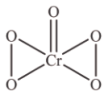
(2)已知: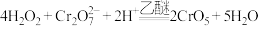 ,
, 结构如图所示,该反应
结构如图所示,该反应_______ (选填“是”或“不是”)氧化还原反应,理由是_______ 。
(3)少量 催化分解
催化分解 的反应分两步进行,第一步:
的反应分两步进行,第一步: ;写出第二步反应的离子方程式。
;写出第二步反应的离子方程式。_______
Ⅱ.称取1.023g (
(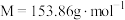 )加入20.0mL
)加入20.0mL 酸化后定容至100mL,取出10.00mL用
酸化后定容至100mL,取出10.00mL用 的
的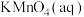 滴定至终点,消耗
滴定至终点,消耗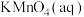 24.34mL。
24.34mL。
已知:①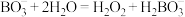
②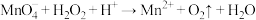 (未配平)
(未配平)
(4)配平离子方程式。_______

(5)实验所需的定量仪器有电子天平、量筒、_______ 。
(6)滴定终点的现象为溶液变为_______ 色,且30s不变色。理论上消耗
_______ mL,实验过程操作正确,产生误差的原因可能是_______ 。
 (H-O-O-H)既有氧化性又有还原性,其中氧处于中间价态。完成下列填空:
(H-O-O-H)既有氧化性又有还原性,其中氧处于中间价态。完成下列填空:(1)
 是二元弱酸,则
是二元弱酸,则 的第一步电离方程式为
的第一步电离方程式为(2)已知:
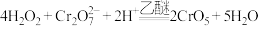 ,
, 结构如图所示,该反应
结构如图所示,该反应
(3)少量
 催化分解
催化分解 的反应分两步进行,第一步:
的反应分两步进行,第一步: ;写出第二步反应的离子方程式。
;写出第二步反应的离子方程式。Ⅱ.称取1.023g
 (
(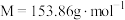 )加入20.0mL
)加入20.0mL 酸化后定容至100mL,取出10.00mL用
酸化后定容至100mL,取出10.00mL用 的
的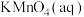 滴定至终点,消耗
滴定至终点,消耗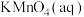 24.34mL。
24.34mL。已知:①
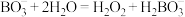
②
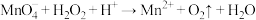 (未配平)
(未配平)(4)配平离子方程式。

(5)实验所需的定量仪器有电子天平、量筒、
(6)滴定终点的现象为溶液变为
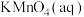
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)现有以下物质:①Ba(OH)2晶体,②金属铜,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
Ⅰ、以上物质中属于电解质的是_________ 。
Ⅱ、以上物质中属于非电解质的是_________ 。
Ⅲ、请写出①在水溶液中的电离方程式_________ 。
(2)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有_________ (填“氧化性”或“还原性”)。
(3)当光束通过下列物质时,会出现丁达尔效应的是_________ 。
①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
(4)用单线桥 标出下列反应中电子转移的情况:_________ 。
8NH3+6NO2 7N2+12H2O
7N2+12H2O
(5)请写出最恰当的试剂或方法除去括号中的杂质:
①CO2(HCl)_________ 。
②Na2CO3(NaHCO3)_________ 。
(1)现有以下物质:①Ba(OH)2晶体,②金属铜,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
Ⅰ、以上物质中属于电解质的是
Ⅱ、以上物质中属于非电解质的是
Ⅲ、请写出①在水溶液中的电离方程式
(2)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
(3)当光束通过下列物质时,会出现丁达尔效应的是
①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
(4)用
8NH3+6NO2
 7N2+12H2O
7N2+12H2O(5)请写出最恰当的试剂或方法除去括号中的杂质:
①CO2(HCl)
②Na2CO3(NaHCO3)
您最近一年使用:0次
2022-12-05更新
|
81次组卷
|
2卷引用:上海市市西中学2023-2024学年高二上学期期末化学模拟试卷
10 . 利用如图所示的“价-类”二维图,可以从物质类别、化合价角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质(庚、辛为钾盐)。回答下列问题:
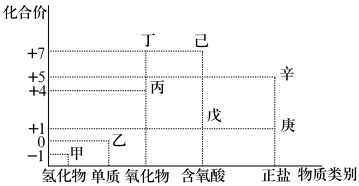
(1)丙的化学式为_______ ;
(2)甲、乙、丁、戊、辛中,属于电解质的是_______ (填化学式);
(3)甲、乙、丁、戊、庚中,属于共价化合物的是_______ (填化学式);
(4)写出己的电离方程式_______ ;
(5)根据氯元素的化合价判断,乙_______ (填序号);
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性 d.既能作氧化剂又能作还原剂
(6)向盛有淀粉KI溶液的试管中滴加乙的水溶液至过量,观察到溶液变蓝,请用文字和方程式说明产生该现象的原因_______ ;继续通氯气后溶液后又褪色,请解释可能的原因_______ 。
(7)实验室中所用少量氯气也可用下列方法制取:K2Cr2O7+14HCl(浓) =2KCl+2CrCl3+3Cl2↑+7H2O,该氧化剂与还原剂的比为_______ ;该反应中每有73gHCl被氧化,生成标况下Cl2的体积为_______ L。

(1)丙的化学式为
(2)甲、乙、丁、戊、辛中,属于电解质的是
(3)甲、乙、丁、戊、庚中,属于共价化合物的是
(4)写出己的电离方程式
(5)根据氯元素的化合价判断,乙
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性 d.既能作氧化剂又能作还原剂
(6)向盛有淀粉KI溶液的试管中滴加乙的水溶液至过量,观察到溶液变蓝,请用文字和方程式说明产生该现象的原因
(7)实验室中所用少量氯气也可用下列方法制取:K2Cr2O7+14HCl(浓) =2KCl+2CrCl3+3Cl2↑+7H2O,该氧化剂与还原剂的比为
您最近一年使用:0次



