名校
1 . 煤燃烧排放的烟气含有 和
和 ,是大气的重要污染源之一、用
,是大气的重要污染源之一、用 溶液对烟气
溶液对烟气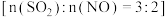 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ),测得NO、
),测得NO、 脱除率如图,下列说法错误的是
脱除率如图,下列说法错误的是
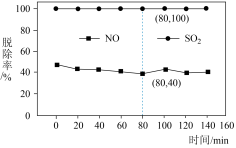
 和
和 ,是大气的重要污染源之一、用
,是大气的重要污染源之一、用 溶液对烟气
溶液对烟气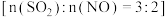 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ),测得NO、
),测得NO、 脱除率如图,下列说法错误的是
脱除率如图,下列说法错误的是
A.酸性环境下脱除NO的反应: |
| B.随着脱除反应的进行,吸收溶液的pH逐渐减小 |
C. 脱除率高于NO的原因可能是 脱除率高于NO的原因可能是 在水中的溶解度大于NO 在水中的溶解度大于NO |
D.依据图中信息,在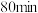 时,吸收液中 时,吸收液中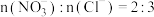 |
您最近一年使用:0次
2023-03-31更新
|
470次组卷
|
6卷引用:福建省福州市福建师范大学附属中学2021届高三上学期期中考试化学试题
名校
解题方法
2 . 下列离子方程式书写错误的是
A. 溶液中滴加少量稀 溶液中滴加少量稀 |
B.酸性 溶液滴加双氧水: 溶液滴加双氧水: |
C.石灰乳和卤水作用制取 |
D.泡沫灭火器中 溶液和 溶液和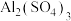 溶液混合: 溶液混合: |
您最近一年使用:0次
2020-12-30更新
|
214次组卷
|
2卷引用:河北省邯郸市2021届高三上学期期末质量检测化学试题
名校
解题方法
3 . 某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
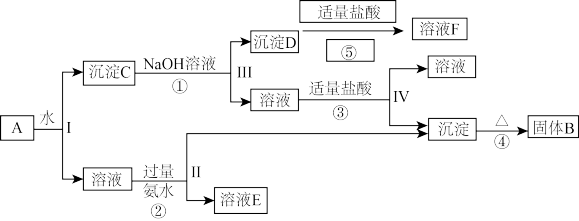
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是__ 。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式:
固体B__ ;沉淀D_ ;溶液E__ 。
(3)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3__ ;Fe2O3__ 。
(4)写出①、④两个反应的化学方程式:
①__ ;④__ 。
(5)写出②、③两个反应的离子方程式:
②__ ;③__ 。

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式:
固体B
(3)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3
(4)写出①、④两个反应的化学方程式:
①
(5)写出②、③两个反应的离子方程式:
②
您最近一年使用:0次
名校
解题方法
4 . 作为绿色氧化剂和消毒剂,H2O2在工业生产及日常生活中应用广泛。已知:2H2O2(l)=2H2O(l)+O2(g) △H = -196kJ·mol-1K = 8.29×1040,回答下列问题:
(1)H2O2的电子式为______ ,H2O2能用作消毒剂是因为分子结构中存在______ 键(选填“H-O”或“-O-O-”)。
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的______ (选填编号)。
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。
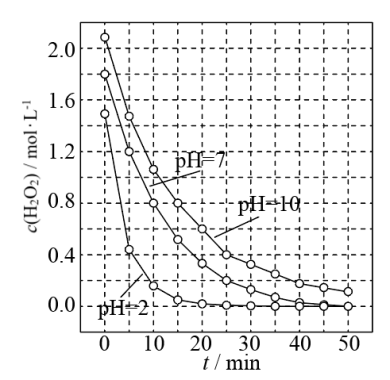
①pH=7时,0~10minH2O2分解反应的平均速率υ=______ mol·L-1·min-1。
②以下对图象的分析正确的是______ (选填序号)。
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因______ 。
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为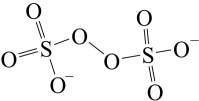 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因_____ 。
(1)H2O2的电子式为
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。

①pH=7时,0~10minH2O2分解反应的平均速率υ=
②以下对图象的分析正确的是
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为
 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
您最近一年使用:0次
2020-12-14更新
|
449次组卷
|
2卷引用:湖北省十一校2021届高三上学期第一次联考化学试题
名校
解题方法
5 . 下列反应的离子方程式正确的是( )
| A.Fe3O4粉末溶于足量的稀硝酸:Fe3O4 + 8H+ = 2Fe2+ + Fe3+ + 4H2O |
| B.FeSO4溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2= Fe3++2H2O |
C.用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: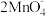 + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O |
| D.实验室中制氯气:MnO2 + 4HCl(浓)=Mn2++ 2Cl- + Cl2 ↑ + 2H2O |
您最近一年使用:0次
名校
6 . 离子反应与工农业生产、日常生活、科学实验有密切关系。
(1)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(σ)随新物质加入量(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是___ 。

①向NH3•H2O溶液中通入HCl气体至过量
②向饱和石灰水中不断通入CO2
③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量
(2)某试液中只含有Na+、NH 、Fe2+、Cl-、SO
、Fe2+、Cl-、SO 、CO
、CO 中的若干种离子,离子浓度均为0.1mol•L-1。某化学小组同学进行如图实验测定溶液的成分:
中的若干种离子,离子浓度均为0.1mol•L-1。某化学小组同学进行如图实验测定溶液的成分:

已知:I.NO 在酸性条件下具有强氧化性,通常还原产物为NO;
在酸性条件下具有强氧化性,通常还原产物为NO;
II.NH 与强碱反应生成氨气。
与强碱反应生成氨气。
①加入过量稀硫酸无明显变化,判断肯定不存在的离子有___ (写离子符号)。
②写出加入过量Ba(NO3)2溶液后生成气体的离子方程式___ 。
③沉淀B、C分别是___ 、___ (写化学式)。
④通过实验可以确定原试液中存在的离子有___ (写离子符号)。
(1)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(σ)随新物质加入量(V)的变化曲线如图所示。分别与A、B、C曲线变化趋势一致的是

①向NH3•H2O溶液中通入HCl气体至过量
②向饱和石灰水中不断通入CO2
③向硝酸中逐滴加入等浓度的氢氧化钾溶液至过量
(2)某试液中只含有Na+、NH
 、Fe2+、Cl-、SO
、Fe2+、Cl-、SO 、CO
、CO 中的若干种离子,离子浓度均为0.1mol•L-1。某化学小组同学进行如图实验测定溶液的成分:
中的若干种离子,离子浓度均为0.1mol•L-1。某化学小组同学进行如图实验测定溶液的成分:
已知:I.NO
 在酸性条件下具有强氧化性,通常还原产物为NO;
在酸性条件下具有强氧化性,通常还原产物为NO;II.NH
 与强碱反应生成氨气。
与强碱反应生成氨气。①加入过量稀硫酸无明显变化,判断肯定不存在的离子有
②写出加入过量Ba(NO3)2溶液后生成气体的离子方程式
③沉淀B、C分别是
④通过实验可以确定原试液中存在的离子有
您最近一年使用:0次
2020-11-25更新
|
168次组卷
|
2卷引用:山东省德州市2020-20201学年高一上学期期中考试化学试题
解题方法
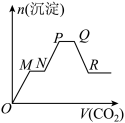
7 . 将足量的 不断通入
不断通入 、
、 、
、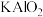 的混合溶液中,生成沉淀的物质的量与所通入
的混合溶液中,生成沉淀的物质的量与所通入 的体积关系如图所示。下列说法不正确的是[已知
的体积关系如图所示。下列说法不正确的是[已知 能与
能与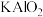 反应生成
反应生成 和
和 ]( )
]( )
 不断通入
不断通入 、
、 、
、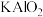 的混合溶液中,生成沉淀的物质的量与所通入
的混合溶液中,生成沉淀的物质的量与所通入 的体积关系如图所示。下列说法不正确的是[已知
的体积关系如图所示。下列说法不正确的是[已知 能与
能与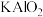 反应生成
反应生成 和
和 ]( )
]( )
A. 段对应反应的化学方程式为 段对应反应的化学方程式为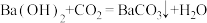 |
B. 段与 段与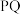 段所发生的反应相同 段所发生的反应相同 |
C. 段沉淀减少的原因是 段沉淀减少的原因是 沉淀溶解 沉淀溶解 |
D. 段发生的反应为 段发生的反应为 |
您最近一年使用:0次
名校
解题方法
8 . 铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强,必须进行处理。工业上往往采取下列循环工艺防止铬的污染:

(1)上述各步反应中属于氧化还原反应的是_______ (填序号)。
(2)第①步,含 的废水在酸性条件下用绿矾(FeSO4·7H2O)溶液处理,写出并配平反应的离子方程式:
的废水在酸性条件下用绿矾(FeSO4·7H2O)溶液处理,写出并配平反应的离子方程式:________ 。
(3)第②步,向上述反应后的溶液中加入适量的碱石灰,使铬离子转变为Cr(OH)3沉淀。处理后,沉淀物中除了Cr(OH)3外,还有_______ 、_______ (写化学式)。已知Cr(OH)3性质类似Al(OH)3,是既能与强酸反应又能与强碱反应的两性物质,从沉淀中分离出Cr(OH)3的流程如下:

写出加入NaOH溶液所发生的主要离子反应方程式_______ ;通入过量CO2,含铬物质所发生的离子反应方程式为_______ 。
(4)回收所得的Cr(OH)3,经③④⑤步处理后又可转变成K2Cr2O7。可用如下方法测定制得的K2Cr2O7的纯度
①准确称取样品0.122 5 g 溶于水,加入足量硫酸和KI溶液,发生反应: +6I-+14H+===3I2+2Cr3++7H2用双线桥法表示该反应转移的电子的方向和数目
+6I-+14H+===3I2+2Cr3++7H2用双线桥法表示该反应转移的电子的方向和数目__________ 。
②再向反应所得溶液中滴加0.1mol/L Na2S2O3至恰好完全反应,方程式为:2 +I2===
+I2=== +2I-,消耗Na2S2O3溶液24.50 mL,则所制备的K2Cr2O7样品的纯度为
+2I-,消耗Na2S2O3溶液24.50 mL,则所制备的K2Cr2O7样品的纯度为________ (保留四位有效数字)。

(1)上述各步反应中属于氧化还原反应的是
(2)第①步,含
 的废水在酸性条件下用绿矾(FeSO4·7H2O)溶液处理,写出并配平反应的离子方程式:
的废水在酸性条件下用绿矾(FeSO4·7H2O)溶液处理,写出并配平反应的离子方程式:(3)第②步,向上述反应后的溶液中加入适量的碱石灰,使铬离子转变为Cr(OH)3沉淀。处理后,沉淀物中除了Cr(OH)3外,还有

写出加入NaOH溶液所发生的主要离子反应方程式
(4)回收所得的Cr(OH)3,经③④⑤步处理后又可转变成K2Cr2O7。可用如下方法测定制得的K2Cr2O7的纯度
①准确称取样品0.122 5 g 溶于水,加入足量硫酸和KI溶液,发生反应:
 +6I-+14H+===3I2+2Cr3++7H2用双线桥法表示该反应转移的电子的方向和数目
+6I-+14H+===3I2+2Cr3++7H2用双线桥法表示该反应转移的电子的方向和数目②再向反应所得溶液中滴加0.1mol/L Na2S2O3至恰好完全反应,方程式为:2
 +I2===
+I2=== +2I-,消耗Na2S2O3溶液24.50 mL,则所制备的K2Cr2O7样品的纯度为
+2I-,消耗Na2S2O3溶液24.50 mL,则所制备的K2Cr2O7样品的纯度为
您最近一年使用:0次
名校
解题方法
9 . 电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
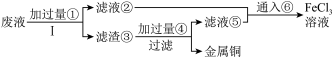
(1)写出FeCl3溶液与铜箔发生反应的离子方程式:____________ 。
(2)检验废腐蚀液中是否含有Fe3+所需试剂名称:________ ,实验现象:______________ 。
(3)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:___________ ,此转化的化学方程式为:______________ 。
(4)写出③中所含物质:________ ,⑥发生反应的离子方程式:_______ 。

(1)写出FeCl3溶液与铜箔发生反应的离子方程式:
(2)检验废腐蚀液中是否含有Fe3+所需试剂名称:
(3)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:
(4)写出③中所含物质:
您最近一年使用:0次
2020-09-04更新
|
242次组卷
|
2卷引用:湖南省长沙市雨花区2019-2020学年高一上学期期末考试化学试题
解题方法
10 . 离子化合物A由三种常见的短周期元素组成,其中阳离子与阴离子的个数比为1:2。按以下流程进行实验:

请回答:
(1)组成A的元素为_________ , A中阴离子的化学式为_________ 。
(2)A与盐酸反应的离子方程式为_________ 。
(3)在一定条件下,A能将二氧化碳与水转化为甲醇,同时生成C,请写出该反应的化学方程式_________ 。

请回答:
(1)组成A的元素为
(2)A与盐酸反应的离子方程式为
(3)在一定条件下,A能将二氧化碳与水转化为甲醇,同时生成C,请写出该反应的化学方程式
您最近一年使用:0次



