1 . 硫酸四氨合铜晶体( )常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备
)常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备 的流程如下:
的流程如下:
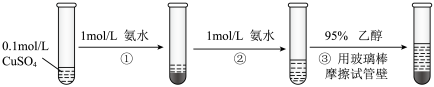
请回答:
(1)写出过程②发生反应的离子方程式_______ 。
(2)过程③加入95%乙醇的作用是_______ 。
(3)根据①→②→③的现象,给出相应微粒与 结合由弱到强的排序
结合由弱到强的排序_______ 。
(4) 具有对称的空间构型,若其中两个
具有对称的空间构型,若其中两个 被两个
被两个 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为_______ 。
(5)下列说法正确的是_______。
 )常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备
)常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备 的流程如下:
的流程如下:
请回答:
(1)写出过程②发生反应的离子方程式
(2)过程③加入95%乙醇的作用是
(3)根据①→②→③的现象,给出相应微粒与
 结合由弱到强的排序
结合由弱到强的排序(4)
 具有对称的空间构型,若其中两个
具有对称的空间构型,若其中两个 被两个
被两个 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为(5)下列说法正确的是_______。
A.③中发生反应的离子方程式为: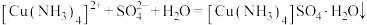 |
| B.③中用玻璃棒摩擦器壁可以促进晶体析出 |
C. 晶体中存在共价键、配位键、离子键和氢键 晶体中存在共价键、配位键、离子键和氢键 |
D.硫酸四氨合铜晶体在水中的电离方程式为: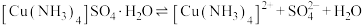 |
您最近半年使用:0次
名校
2 . 钠和氯的化合物常用于化工生产与生活中。
(1)将一小块钠放在水平放置的试管中部,用酒精灯加热至充分反应,化学方程式为_______ 。将试管冷却后加水,发生反应的离子方程式为_______ 。
(2)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL。
①完成本实验需要用托盘天平称量NaOH_______ g。
②在配制过程中,若其他操作都正确,下列操作会使浓度偏高的是_______ (填序号)。
A.定容时仰视刻度线 B.未冷就转移溶液
C.未洗涤烧杯和玻璃棒 D.NaOH已部分变质
(3) 将逐渐用来取代
将逐渐用来取代 成为自来水的消毒剂。已知
成为自来水的消毒剂。已知 是一种易溶于水难溶于有机物的气体,
是一种易溶于水难溶于有机物的气体, 等卤素单质在水中溶解度远小于在有机溶剂
等卤素单质在水中溶解度远小于在有机溶剂 中的溶解度。制备
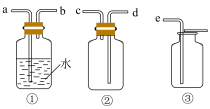
中的溶解度。制备 的原理为
的原理为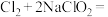
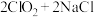 。实验装置如下图:
。实验装置如下图:
①装置A中浓盐酸和二氧化锰发生反应的化学方程式为_______ 。
②E中加入的试剂可以是_______ (任意填一种)。
③F用于收集ClO2,可选用_______ (气流均左进右出)。
(1)将一小块钠放在水平放置的试管中部,用酒精灯加热至充分反应,化学方程式为
(2)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL。
①完成本实验需要用托盘天平称量NaOH
②在配制过程中,若其他操作都正确,下列操作会使浓度偏高的是
A.定容时仰视刻度线 B.未冷就转移溶液
C.未洗涤烧杯和玻璃棒 D.NaOH已部分变质
(3)
 将逐渐用来取代
将逐渐用来取代 成为自来水的消毒剂。已知
成为自来水的消毒剂。已知 是一种易溶于水难溶于有机物的气体,
是一种易溶于水难溶于有机物的气体, 等卤素单质在水中溶解度远小于在有机溶剂
等卤素单质在水中溶解度远小于在有机溶剂 中的溶解度。制备
中的溶解度。制备 的原理为
的原理为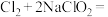
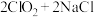 。实验装置如下图:
。实验装置如下图:
①装置A中浓盐酸和二氧化锰发生反应的化学方程式为
②E中加入的试剂可以是
③F用于收集ClO2,可选用

您最近半年使用:0次
名校
解题方法
3 . 某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
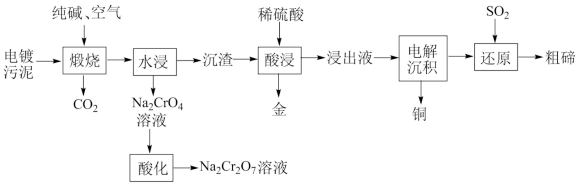
已知:煅烧时, 发生的反应为:
发生的反应为:
(1)煅烧时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)浸出液中除了含有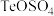 (在电解过程中不反应)外,还含有
(在电解过程中不反应)外,还含有___________ (填化学式)。“还原”步骤后,得到的粗碲经洗涤后可以得到较为纯净的碲单质,检验碲单质是否洗涤干净的实验操作:___________ 。
(3)工业上用重铬酸钠( )母液生产重铬酸钾(
)母液生产重铬酸钾( )的工艺流程如图所示:
)的工艺流程如图所示:
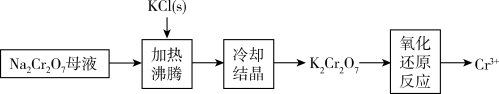
通过冷却结晶能析出大量 的原因是
的原因是___________ 。
(4)测定产品中 (
(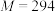 g/mol)含量的方法如下:称取试样2.50 g配成250 mL溶液,取25.00 mL样品置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用
g/mol)含量的方法如下:称取试样2.50 g配成250 mL溶液,取25.00 mL样品置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用 标准液可以测定
标准液可以测定 的含量,涉及的离子反应方程式为
的含量,涉及的离子反应方程式为___________ 。若消耗0.1000 mol/L  标准液的体积为25.00 mL,则所得产品中
标准液的体积为25.00 mL,则所得产品中 的纯度为
的纯度为___________ 。

已知:煅烧时,
 发生的反应为:
发生的反应为:
(1)煅烧时,
 发生反应的化学方程式为
发生反应的化学方程式为(2)浸出液中除了含有
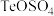 (在电解过程中不反应)外,还含有
(在电解过程中不反应)外,还含有(3)工业上用重铬酸钠(
 )母液生产重铬酸钾(
)母液生产重铬酸钾( )的工艺流程如图所示:
)的工艺流程如图所示:
通过冷却结晶能析出大量
 的原因是
的原因是(4)测定产品中
 (
(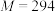 g/mol)含量的方法如下:称取试样2.50 g配成250 mL溶液,取25.00 mL样品置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用
g/mol)含量的方法如下:称取试样2.50 g配成250 mL溶液,取25.00 mL样品置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用 标准液可以测定
标准液可以测定 的含量,涉及的离子反应方程式为
的含量,涉及的离子反应方程式为 标准液的体积为25.00 mL,则所得产品中
标准液的体积为25.00 mL,则所得产品中 的纯度为
的纯度为
您最近半年使用:0次
名校
解题方法
4 . 宏观辨识、微观探析和符号表征是体现化学学科特征的思维方式。某化学兴趣小组设计实验,探究离子反应及氧化还原反应的本质。回答下列问题:

Ⅰ.离子反应
(1)向 溶液中滴入几滴酚酞溶液(装置如图所示),接通电源,向该溶液中滴入
溶液中滴入几滴酚酞溶液(装置如图所示),接通电源,向该溶液中滴入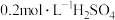 溶液。
溶液。
①接通电源前,能说明 在水中电离的实验现象为
在水中电离的实验现象为_____ 。
②随着 溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是
溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是 和
和 浓度降低,该反应的离子方程式为
浓度降低,该反应的离子方程式为_____ 。
(2)向 溶液中逐滴滴入
溶液中逐滴滴入 盐酸,测定溶液电导率的变化如图所示。
盐酸,测定溶液电导率的变化如图所示。

① 点恰好完全反应,此时溶液中存在的主要微粒有
点恰好完全反应,此时溶液中存在的主要微粒有 、
、_____ 。
②下列化学反应的离子方程式与 溶液和稀盐酸反应相同的是
溶液和稀盐酸反应相同的是_____ (填标号)。
A. 溶液和稀硫酸反应
溶液和稀硫酸反应
B.氨水和稀盐酸反应
C. 溶液和
溶液和 溶液反应
溶液反应
D.澄清石灰水和稀硝酸反应
Ⅱ.氧化还原反应
(3)部分含硫物质如图所示,其中 和
和 是大气污染物。这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持。
是大气污染物。这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持。
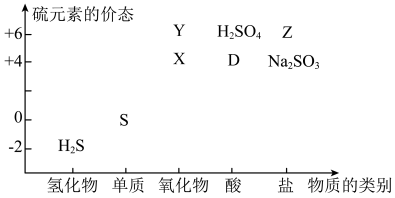
已知 可发生下列过程:
可发生下列过程: ,其中反应①的离子方程式是
,其中反应①的离子方程式是_____ ,若欲将X转化成“安全物质”Z,使其对环境的影响最小,需加入_____ (填标号)。
A.酸性物质 B.碱性物质 C.氧化剂 D.还原剂
 转化为
转化为 可以说明氧化还原反应的本质是发生了
可以说明氧化还原反应的本质是发生了_____ 。

Ⅰ.离子反应
(1)向
 溶液中滴入几滴酚酞溶液(装置如图所示),接通电源,向该溶液中滴入
溶液中滴入几滴酚酞溶液(装置如图所示),接通电源,向该溶液中滴入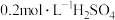 溶液。
溶液。①接通电源前,能说明
 在水中电离的实验现象为
在水中电离的实验现象为②随着
 溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是
溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是 和
和 浓度降低,该反应的离子方程式为
浓度降低,该反应的离子方程式为(2)向
 溶液中逐滴滴入
溶液中逐滴滴入 盐酸,测定溶液电导率的变化如图所示。
盐酸,测定溶液电导率的变化如图所示。
①
 点恰好完全反应,此时溶液中存在的主要微粒有
点恰好完全反应,此时溶液中存在的主要微粒有 、
、②下列化学反应的离子方程式与
 溶液和稀盐酸反应相同的是
溶液和稀盐酸反应相同的是A.
 溶液和稀硫酸反应
溶液和稀硫酸反应B.氨水和稀盐酸反应
C.
 溶液和
溶液和 溶液反应
溶液反应D.澄清石灰水和稀硝酸反应
Ⅱ.氧化还原反应
(3)部分含硫物质如图所示,其中
 和
和 是大气污染物。这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持。
是大气污染物。这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持。
已知
 可发生下列过程:
可发生下列过程: ,其中反应①的离子方程式是
,其中反应①的离子方程式是A.酸性物质 B.碱性物质 C.氧化剂 D.还原剂
 转化为
转化为 可以说明氧化还原反应的本质是发生了
可以说明氧化还原反应的本质是发生了
您最近半年使用:0次
2023-10-02更新
|
90次组卷
|
4卷引用:甘肃省酒泉市2023-2024学年高三上学期10月联考化学试题
名校
5 . 电解质对人体来说非常重要,它广泛分布在细胞内外,参与了许多重要的功能和代谢活动,维持着人体正常机能的运转。
(1)下列化学用语表述正确的是______ (单选)。
(2)下列方法中,可使0.01mol/LCH3COOH溶液中增大的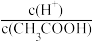 是
是______ (单选)。
(3)常温下,将pH=2的酸HA溶液某和pH=12的NaOH溶液等体积混合后,混合溶液的pH=5。该混合溶液中c(A-)-c(Na+)=______ mol/L(填数值,无需计算)。
(4)常温下,下列各组离子在指定溶液中一定不能大量共存的是______ (不定项)。
(5)常温测得稀NaHCO3溶液pH>8,则溶液中c(H2CO3)_____ c( ) (填“>”、“<”或“=”)。
) (填“>”、“<”或“=”)。
(6)常温下,用0.1000mol•L-1的NaOH溶液滴定20.00mL0.1000mol•L-1醋酸(CH3COOH),滴定曲线如图所示,下列说法正确的是______ (单选)。
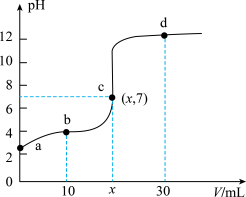
已知:Ka(CH3COOH)≈1.8×10-5。
(7)向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl-)升高的原因:_____ 。
(1)下列化学用语表述正确的是
A.自然界正常雨水pH=5.6是因为:H2O+CO2 H2CO3,H2CO3 H2CO3,H2CO3 2H++ 2H++  |
B.过量铁和稀硝酸反应的离子方程式:Fe+4H++  =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
C.向NaHCO3溶液中加足量Ba(OH)2溶液:  +Ba2++OH-=BaCO3↓+H2O +Ba2++OH-=BaCO3↓+H2O |
D.用Na2CO3溶液处理水垢中的CaSO4: +Ca2+=CaCO3↓ +Ca2+=CaCO3↓ |
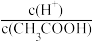 是
是| A.降低温度 | B.加入少量CH3COONa固体 |
| C.通入少量HCl气体 | D.加入少量冰醋酸 |
(4)常温下,下列各组离子在指定溶液中一定不能大量共存的是
A.加入铝片能产生H2的溶液中:Fe3+、 、Br-、 、Br-、 |
B. =106的溶液中: =106的溶液中: 、K+、 、K+、 、 、 |
C.加入酚酞试剂会变红的溶液中:Cu2+、Mg2+、 、Cl- 、Cl- |
D.水电离产生的c(H+)=10-12的溶液中:Na+、 、 、 、CH3COO- 、CH3COO- |
 ) (填“>”、“<”或“=”)。
) (填“>”、“<”或“=”)。(6)常温下,用0.1000mol•L-1的NaOH溶液滴定20.00mL0.1000mol•L-1醋酸(CH3COOH),滴定曲线如图所示,下列说法正确的是

已知:Ka(CH3COOH)≈1.8×10-5。
| A.四个点对应溶液中,d点对应水的电离程度最大 |
| B.b点溶液中c(CH3COOH)+c(CH3COO-)<2c(Na+) |
| C.c点溶液中,c(Na+)>c(CH3COO-) |
| D.d点溶液中含有6种不同的微粒 |
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
6 . 下列反应的离子方程式不正确 的是_______
A.常温下将硝酸铵溶液与KOH溶液混合:NH +OH-=NH3↑+H2O
+OH-=NH3↑+H2O
B.常温下铝和浓硝酸混合:Al+6H++3NO =Al3++3NO2↑+3H2O
=Al3++3NO2↑+3H2O
C. (2014•北京高考)用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl-
Cu2++2Cl-
A.常温下将硝酸铵溶液与KOH溶液混合:NH
 +OH-=NH3↑+H2O
+OH-=NH3↑+H2OB.常温下铝和浓硝酸混合:Al+6H++3NO
 =Al3++3NO2↑+3H2O
=Al3++3NO2↑+3H2OC. (2014•北京高考)用CuCl2溶液做导电实验,灯泡发光:CuCl2
 Cu2++2Cl-
Cu2++2Cl-
您最近半年使用:0次
2023高三·全国·专题练习
7 . 下列反应的离子方程式不正确 的是_______ 。
A. (2013·大纲版全国卷)氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O
SO2↑+Cl2↑+H2O
B.铜片与浓硫酸加热反应:Cu+4H++SO
 SO2↑+Cu2++2H2O
SO2↑+Cu2++2H2O
C.工业上制取漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D.实验室制NH3:NH +OH-
+OH- NH3↑+H2O
NH3↑+H2O
E.电解熔融MgCl2:Mg2++2Cl− Mg+Cl2↑
Mg+Cl2↑
A. (2013·大纲版全国卷)氯化钠与浓硫酸混合加热:H2SO4+2Cl-
 SO2↑+Cl2↑+H2O
SO2↑+Cl2↑+H2OB.铜片与浓硫酸加热反应:Cu+4H++SO

 SO2↑+Cu2++2H2O
SO2↑+Cu2++2H2OC.工业上制取漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D.实验室制NH3:NH
 +OH-
+OH- NH3↑+H2O
NH3↑+H2OE.电解熔融MgCl2:Mg2++2Cl−
 Mg+Cl2↑
Mg+Cl2↑
您最近半年使用:0次
名校
8 . 已知:常温下,部分弱电解质的电离平衡常数如下表所示,回答下列问题:
(1)常温下,物质的量浓度相等的下列溶液 由大到小的顺序是
由大到小的顺序是_______ (填序号)。
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液
(2)25℃时,将amolNaF溶于水溶液呈碱性,原因是_______ (用离子方程式表示)。向该溶液中滴加bLHF溶液后溶液呈中性,则滴加HF溶液的过程中水的电离平衡将_______ (填“正向”“不”或“逆向”)移动,所滴加HF溶液的浓度为_______  。
。
(3)下列离子方程式错误的是_______ (填序号)。
①向 溶液中通入过量
溶液中通入过量 气体:
气体: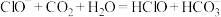
②向 溶液中通入少量
溶液中通入少量 气体:
气体: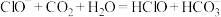
③向 溶液中通入少量
溶液中通入少量 气体:
气体: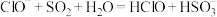
④向 溶液中加入过量
溶液中加入过量 溶液:
溶液:
(4)已知:常温下 的溶度积常数
的溶度积常数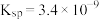 ,计算反应
,计算反应 常温下的化学平衡常数
常温下的化学平衡常数
_______ (保留两位有效数字)。
向氯水中加入下列物质可以使 浓度增大的是
浓度增大的是_______ (填序号)。
① 固体 ②
固体 ② 固体 ③
固体 ③ 固体 ④
固体 ④ 固体
固体
(1)常温下,物质的量浓度相等的下列溶液
 由大到小的顺序是
由大到小的顺序是 |  |  |  |  | |
 | 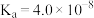 |  | 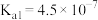 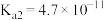 |  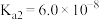 |  |
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液(2)25℃时,将amolNaF溶于水溶液呈碱性,原因是
 。
。(3)下列离子方程式错误的是
①向
 溶液中通入过量
溶液中通入过量 气体:
气体: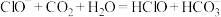
②向
 溶液中通入少量
溶液中通入少量 气体:
气体: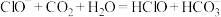
③向
 溶液中通入少量
溶液中通入少量 气体:
气体: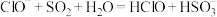
④向
 溶液中加入过量
溶液中加入过量 溶液:
溶液:
(4)已知:常温下
 的溶度积常数
的溶度积常数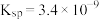 ,计算反应
,计算反应 常温下的化学平衡常数
常温下的化学平衡常数
向氯水中加入下列物质可以使
 浓度增大的是
浓度增大的是①
 固体 ②
固体 ② 固体 ③
固体 ③ 固体 ④
固体 ④ 固体
固体
您最近半年使用:0次
2023-01-14更新
|
195次组卷
|
2卷引用:山东省济南市章丘区第四中学2022-2023学年高二上学期期末考试(线上)化学试题
名校
解题方法
9 . 硫酸铁铵[化学式可表示为NH4Fe(SO4)2]可用作分析试剂。某兴趣小组利用铁矿石(主要成分为FeO、Fe2O3)制备硫酸铁铵的流程如下:

回答下列问题:
(1)溶液A中所含金属阳离子有_______ 。
(2)写出加入H2O2发生反应的离子方程式_______ 。
(3)某同学探究NH4Fe(SO4)2与Ba(OH)2反应生成最大质量沉淀的条件,向含amol NH4Fe(SO4)2的溶液中滴入含bmol Ba(OH)2的溶液
①当a=b时,发生的离子反应为_______
②当1.5a<b<2a时,反应后溶液中 与
与 的浓度之比为
的浓度之比为_______
③当_______ 时,能使生成的沉淀质量最大(填a与b之间的关系)。

回答下列问题:
(1)溶液A中所含金属阳离子有
(2)写出加入H2O2发生反应的离子方程式
(3)某同学探究NH4Fe(SO4)2与Ba(OH)2反应生成最大质量沉淀的条件,向含amol NH4Fe(SO4)2的溶液中滴入含bmol Ba(OH)2的溶液
①当a=b时,发生的离子反应为
②当1.5a<b<2a时,反应后溶液中
 与
与 的浓度之比为
的浓度之比为③当
您最近半年使用:0次
10 . 25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka_______ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是_______ (填字母)。
a.CO b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是_______ (填字母)。
a. CO +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO +2HClO
+2HClO
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=_______ mol·L-1(填精确数值)。
(5)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.0×10-20
①25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______ 。
②25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成_______ 沉淀(填化学式);当两种沉淀共存时,c(Mg2+)/c(Cu2+)=_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a.CO
 b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(3)下列反应不能发生的是
a. CO
 +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO
 +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO
 +2HClO
+2HClO(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=
(5)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.0×10-20
①25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为
②25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成
您最近半年使用:0次



