名校
解题方法
1 . 完成下列问题
(1)下列各组离子,在所给条件下一定能够大量共存的是_______
①pH=7的溶液中:Fe3+、Mg2+、 、
、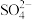
②加入苯酚显紫色的溶液中:Na+、Mg2+、Cl-、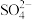 :
:
③能和Ca2+生成沉淀的溶液中:K+、Ba2+、CH3COO-、Cl-
④加入铝粉能放出氢气的溶液中: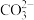 、
、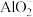 、I-、
、I-、
⑤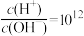 的溶液中:
的溶液中: 、Al3+、Ca2+、Cl-
、Al3+、Ca2+、Cl-
⑥常温下,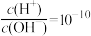 的溶液中:Ca2+、Mg2+、ClO-、I-
的溶液中:Ca2+、Mg2+、ClO-、I-
⑦在含有大量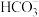 的溶液中:K+、Na+、
的溶液中:K+、Na+、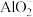 、Br-
、Br-
⑧在使pH试纸变红的溶液中:Fe2+、Na+、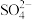 、
、
(2)向NaOH、Na2CO3、NaAlO2溶液中(假设各1mol),逐滴加入HCl溶液,产生沉淀的物质的量随HCl溶液体积变化的图象如下:
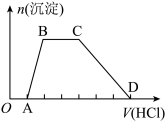
分析图象的变化情况,写出各阶段的离子方程式:
①OA:_______ 。
②AB:_______ 。
③BC:_______ 。
④CD:_______ 。
(3)将xgFe、FeO和Fe2O3混合物分成两等份,向其中一份中滴加500mL稀硝酸,固体恰好完全溶解并产生标准状况下NO气体aL,溶液中Fe元素均以+3价形式存在,另一份固体与足量H2反应质量减少yg。根据以上数据计算稀硝酸的浓度为_______ mol/L。(列式即可,无需化简)
(1)下列各组离子,在所给条件下一定能够大量共存的是
①pH=7的溶液中:Fe3+、Mg2+、
 、
、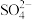
②加入苯酚显紫色的溶液中:Na+、Mg2+、Cl-、
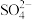 :
:③能和Ca2+生成沉淀的溶液中:K+、Ba2+、CH3COO-、Cl-
④加入铝粉能放出氢气的溶液中:
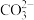 、
、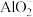 、I-、
、I-、
⑤
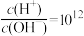 的溶液中:
的溶液中: 、Al3+、Ca2+、Cl-
、Al3+、Ca2+、Cl-⑥常温下,
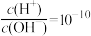 的溶液中:Ca2+、Mg2+、ClO-、I-
的溶液中:Ca2+、Mg2+、ClO-、I-⑦在含有大量
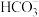 的溶液中:K+、Na+、
的溶液中:K+、Na+、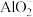 、Br-
、Br-⑧在使pH试纸变红的溶液中:Fe2+、Na+、
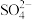 、
、
(2)向NaOH、Na2CO3、NaAlO2溶液中(假设各1mol),逐滴加入HCl溶液,产生沉淀的物质的量随HCl溶液体积变化的图象如下:

分析图象的变化情况,写出各阶段的离子方程式:
①OA:
②AB:
③BC:
④CD:
(3)将xgFe、FeO和Fe2O3混合物分成两等份,向其中一份中滴加500mL稀硝酸,固体恰好完全溶解并产生标准状况下NO气体aL,溶液中Fe元素均以+3价形式存在,另一份固体与足量H2反应质量减少yg。根据以上数据计算稀硝酸的浓度为
您最近一年使用:0次
2 . 某无色、澄清溶液中可能含有Na+、Cl-、 、
、 、Fe3+、OH-、
、Fe3+、OH-、 中的几种,依次进行下列实验,观察到的现象如下:
中的几种,依次进行下列实验,观察到的现象如下:
已知:2Al+2OH-+2H2O=2 +3H2↑。
+3H2↑。
(1)不需要通过实验就能判断原溶液中肯定没有_______ 离子,肯定有_______ 离子。
(2)写出Ⅲ中发生的反应的离子方程式_______ 。
(3)原溶液中可能存在_______ 离子,验证溶液中是否存在此离子的实验方法_______ 。
(4)若(2)中的离子不存在,则溶液中一定存在的阴离子_______ 。
 、
、 、Fe3+、OH-、
、Fe3+、OH-、 中的几种,依次进行下列实验,观察到的现象如下:
中的几种,依次进行下列实验,观察到的现象如下:已知:2Al+2OH-+2H2O=2
 +3H2↑。
+3H2↑。| 步骤 | 操作 | 现象 |
| Ⅰ | 取少量溶液,向其中加入适量铝粉 | 有气体生成 |
| Ⅱ | 另取少量溶液,向其中滴加足量BaCl2溶液 | 有白色沉淀生成 |
| Ⅲ | 向Ⅱ中滴加足量稀盐酸 | 沉淀部分溶解 |
(2)写出Ⅲ中发生的反应的离子方程式
(3)原溶液中可能存在
(4)若(2)中的离子不存在,则溶液中一定存在的阴离子
您最近一年使用:0次
2022-09-10更新
|
228次组卷
|
2卷引用:辽宁省实验中学2022-2023学年高二上学期第一次月考化学试题
21-22高一·全国·假期作业
3 . 溶液A中可能含有如下离子中的若干种:Na+、 、Ba2+、Fe2+、
、Ba2+、Fe2+、 、
、 、
、 、Cl-。
、Cl-。所含离子浓度均相同 。为确定其组成,某实验小组按如下流程进行了实验:
已知: 在H+存在条件下可以和Fe2+发生氧化还原反应,生成Fe3+和不溶于水的无色气体NO
在H+存在条件下可以和Fe2+发生氧化还原反应,生成Fe3+和不溶于水的无色气体NO
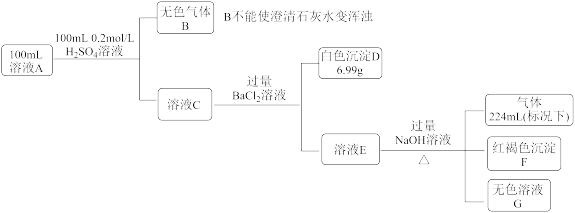
(1)溶液A中各个离子的物质的量浓度为_______ 。
(2)写出 在酸性条件下与Fe2+发生的离子反应方程式
在酸性条件下与Fe2+发生的离子反应方程式_______ 。
(3)溶液A中一定存在的离子是_______ 。
(4)无色溶液G中一定存在的阴离子除 外还有
外还有_______ 。
(5)为确定Na+的存在,除焰色反应外,还可以通过何种方式判断。请设计实验方案_______ 。
 、Ba2+、Fe2+、
、Ba2+、Fe2+、 、
、 、
、 、Cl-。
、Cl-。已知:
 在H+存在条件下可以和Fe2+发生氧化还原反应,生成Fe3+和不溶于水的无色气体NO
在H+存在条件下可以和Fe2+发生氧化还原反应,生成Fe3+和不溶于水的无色气体NO
(1)溶液A中各个离子的物质的量浓度为
(2)写出
 在酸性条件下与Fe2+发生的离子反应方程式
在酸性条件下与Fe2+发生的离子反应方程式(3)溶液A中一定存在的离子是
(4)无色溶液G中一定存在的阴离子除
 外还有
外还有(5)为确定Na+的存在,除焰色反应外,还可以通过何种方式判断。请设计实验方案
您最近一年使用:0次
2022-11-15更新
|
209次组卷
|
4卷引用:第10讲 铵盐的性质-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)
(已下线)第10讲 铵盐的性质-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)浙江省杭州第二中学2022-2023学年高一上学期期中考试化学试题湖北省恩施市第三高级中学2022-2023学年高一上学期期末考试化学试题(已下线)【2022】【高一化学】【期中考】-181
名校
4 . 电解质对人体来说非常重要,它广泛分布在细胞内外,参与了许多重要的功能和代谢活动,维持着人体正常机能的运转。
(1)下列化学用语表述正确的是______ (单选)。
(2)下列方法中,可使0.01mol/LCH3COOH溶液中增大的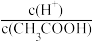 是
是______ (单选)。
(3)常温下,将pH=2的酸HA溶液某和pH=12的NaOH溶液等体积混合后,混合溶液的pH=5。该混合溶液中c(A-)-c(Na+)=______ mol/L(填数值,无需计算)。
(4)常温下,下列各组离子在指定溶液中一定不能大量共存的是______ (不定项)。
(5)常温测得稀NaHCO3溶液pH>8,则溶液中c(H2CO3)_____ c( ) (填“>”、“<”或“=”)。
) (填“>”、“<”或“=”)。
(6)常温下,用0.1000mol•L-1的NaOH溶液滴定20.00mL0.1000mol•L-1醋酸(CH3COOH),滴定曲线如图所示,下列说法正确的是______ (单选)。
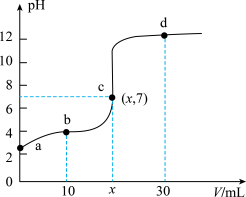
已知:Ka(CH3COOH)≈1.8×10-5。
(7)向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl-)升高的原因:_____ 。
(1)下列化学用语表述正确的是
A.自然界正常雨水pH=5.6是因为:H2O+CO2 H2CO3,H2CO3 H2CO3,H2CO3 2H++ 2H++  |
B.过量铁和稀硝酸反应的离子方程式:Fe+4H++  =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
C.向NaHCO3溶液中加足量Ba(OH)2溶液:  +Ba2++OH-=BaCO3↓+H2O +Ba2++OH-=BaCO3↓+H2O |
D.用Na2CO3溶液处理水垢中的CaSO4: +Ca2+=CaCO3↓ +Ca2+=CaCO3↓ |
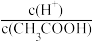 是
是| A.降低温度 | B.加入少量CH3COONa固体 |
| C.通入少量HCl气体 | D.加入少量冰醋酸 |
(4)常温下,下列各组离子在指定溶液中一定不能大量共存的是
A.加入铝片能产生H2的溶液中:Fe3+、 、Br-、 、Br-、 |
B. =106的溶液中: =106的溶液中: 、K+、 、K+、 、 、 |
C.加入酚酞试剂会变红的溶液中:Cu2+、Mg2+、 、Cl- 、Cl- |
D.水电离产生的c(H+)=10-12的溶液中:Na+、 、 、 、CH3COO- 、CH3COO- |
 ) (填“>”、“<”或“=”)。
) (填“>”、“<”或“=”)。(6)常温下,用0.1000mol•L-1的NaOH溶液滴定20.00mL0.1000mol•L-1醋酸(CH3COOH),滴定曲线如图所示,下列说法正确的是

已知:Ka(CH3COOH)≈1.8×10-5。
| A.四个点对应溶液中,d点对应水的电离程度最大 |
| B.b点溶液中c(CH3COOH)+c(CH3COO-)<2c(Na+) |
| C.c点溶液中,c(Na+)>c(CH3COO-) |
| D.d点溶液中含有6种不同的微粒 |
您最近一年使用:0次
名校
解题方法
5 . 某工业废水仅含下表中的某些离子(不考虑水电离产生的 和
和 )。
)。
甲同学欲探究废水的组成,进行如下实验:
Ⅰ.取 溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
Ⅱ.取 溶液加入过量盐酸,无气体和沉淀生成。
溶液加入过量盐酸,无气体和沉淀生成。
Ⅲ.取 溶液,滴加过量
溶液,滴加过量 后,过滤、洗涤、干燥得到
后,过滤、洗涤、干燥得到 沉淀,滴加足量
沉淀,滴加足量 ,得
,得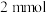 沉淀。
沉淀。
Ⅳ.取 溶液,加入过量
溶液,加入过量 溶液并加热,得到标准状况下
溶液并加热,得到标准状况下 气体。
气体。
请回答下列问题:
(1)以下物质属于电解质的是___________(填字母)。
(2)根据上述信息推断一定存在的阳离子有___________ ,阴离子有___________ 。
(3)实验Ⅰ的现象为___________ 。
(4)实验Ⅲ中发生反应的离子方程式有___________ 、___________ 。
(5)原溶液中浓度最大和最小的离子的物质的量浓度是_______  ,
,_________  。
。
(6)取 溶液,通入
溶液,通入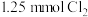 ,对应离子方程式为
,对应离子方程式为___________ 。
 和
和 )。
)。| 阳离子 |  |  |  |  |
| 阴离子 |  |  |  |  |
Ⅰ.取
 溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
溶液,滴加一滴氨水有沉淀生成,且离子种类不变。Ⅱ.取
 溶液加入过量盐酸,无气体和沉淀生成。
溶液加入过量盐酸,无气体和沉淀生成。Ⅲ.取
 溶液,滴加过量
溶液,滴加过量 后,过滤、洗涤、干燥得到
后,过滤、洗涤、干燥得到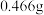 沉淀,滴加足量
沉淀,滴加足量 ,得
,得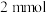 沉淀。
沉淀。Ⅳ.取
 溶液,加入过量
溶液,加入过量 溶液并加热,得到标准状况下
溶液并加热,得到标准状况下 气体。
气体。请回答下列问题:
(1)以下物质属于电解质的是___________(填字母)。
| A.氨气 | B.氨水 | C.液氨 | D.一水合氨 |
(3)实验Ⅰ的现象为
(4)实验Ⅲ中发生反应的离子方程式有
(5)原溶液中浓度最大和最小的离子的物质的量浓度是
 ,
, 。
。(6)取
 溶液,通入
溶液,通入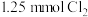 ,对应离子方程式为
,对应离子方程式为
您最近一年使用:0次
解题方法
6 . 某无色透明溶液W中可能大量含表格所示中几种离子。
为了确认W的组成,进行如下实验:
①测定W溶液pH,溶液呈强酸性;
②取少量W溶液于试管,滴加 溶液,产生白色沉淀,过滤,得滤液X;
溶液,产生白色沉淀,过滤,得滤液X;
③在滤液X中滴加 溶液,又产生白色沉淀。
溶液,又产生白色沉淀。
已知:白色 微溶于水,不溶于稀硝酸。
微溶于水,不溶于稀硝酸。
请回答下列问题:
(1)不做实验可以确认W中一定不存在的离子是___________ (填离子符号,下同)。
(2)实验步骤①能确认一定不能大量存在的离子是___________ 和 ,理由是
,理由是___________ 、 )(用离子方程式表示)。
)(用离子方程式表示)。
(3)实验步骤②能确认W中一定存在的离子是___________ ,一定不存在的离子是___________ 。
(4)实验步骤③不能确认W含 ,理由是
,理由是___________ 。补充实验确认W是否含有 :
:___________ 。
(5)根据上述实验,能确认W一定含的溶质是___________ (填化学式),它属于___________ (填字母)。
A.酸 B.盐 C.碱 D.电解质
| 阳离子 |  、 、 、 、 、 、 、 、 |
| 阴离子 |  、 、 、 、 、 、 、 、 |
①测定W溶液pH,溶液呈强酸性;
②取少量W溶液于试管,滴加
 溶液,产生白色沉淀,过滤,得滤液X;
溶液,产生白色沉淀,过滤,得滤液X;③在滤液X中滴加
 溶液,又产生白色沉淀。
溶液,又产生白色沉淀。已知:白色
 微溶于水,不溶于稀硝酸。
微溶于水,不溶于稀硝酸。请回答下列问题:
(1)不做实验可以确认W中一定不存在的离子是
(2)实验步骤①能确认一定不能大量存在的离子是
 ,理由是
,理由是 )(用离子方程式表示)。
)(用离子方程式表示)。(3)实验步骤②能确认W中一定存在的离子是
(4)实验步骤③不能确认W含
 ,理由是
,理由是 :
:(5)根据上述实验,能确认W一定含的溶质是
A.酸 B.盐 C.碱 D.电解质
您最近一年使用:0次
2023-07-13更新
|
131次组卷
|
2卷引用:江西省南昌市2022-2023学年高一上学期11月期中化学试题
7 . 化学是一门实验的科学,滴定法是一种常用的化学定量分析的方法。室温下,用 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
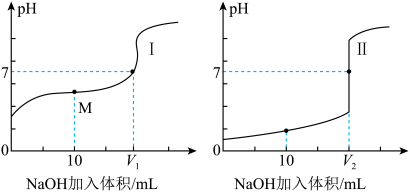
(1)滴定醋酸溶液的曲线是___________ 。(填“Ⅰ”或“Ⅱ”)。
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式___________ 。
(3)滴定开始前,三种溶液中由水电离出的 最大的是
最大的是______ 。
A. 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸
(4)该 溶液的pH为
溶液的pH为______ ;给该溶液加热,pH______ (填“变大”“变小”或“不变”)。
(5)在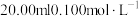 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=___________ 。
(6)取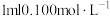 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH=___________ ,此时水电离出的 浓度为
浓度为___________ 。
(7)下列离子一定能大量共存的是___________。
(8)下列叙述正确的是___________。
(9)下列有关实验的说法,正确的是___________。
 溶液分别滴定体积均为20.00mL、浓度均为
溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
(1)滴定醋酸溶液的曲线是
(2)若采用氨水滴定醋酸,写出氨水与醋酸反应的离子反应方程式
(3)滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是A.
 溶液 B.
溶液 B. 盐酸 C.
盐酸 C. 醋酸
醋酸(4)该
 溶液的pH为
溶液的pH为(5)在
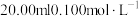 的盐酸中,滴加
的盐酸中,滴加 溶液后,此时溶液的pH=
溶液后,此时溶液的pH=(6)取
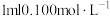 的盐酸稀释1000倍后,溶液pH=
的盐酸稀释1000倍后,溶液pH= 浓度为
浓度为(7)下列离子一定能大量共存的是___________。
A.甲基橙呈黄色的溶液中: 、 、 、 、 、 、 |
B.加入铝粉后产生大量氢气的溶液中: 、 、 、 、 、 、 |
C.石蕊呈蓝色的溶液中: 、 、 、 、 、 、 |
D.pH=1的溶液中: 、 、 、 、 、 、 |
(8)下列叙述正确的是___________。
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下其 |
B.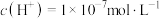 的溶液一定是中性溶液 的溶液一定是中性溶液 |
C.向水中加入少量固体 ,水的电离平衡逆向移动, ,水的电离平衡逆向移动, 减小 减小 |
D.将水加热, 增大,pH不变 增大,pH不变 |
(9)下列有关实验的说法,正确的是___________。
| A.测定HClO溶液pH时,用玻璃棒蘸取溶液,点在干燥pH试纸上 |
| B.等体积、等pH的硫酸与醋酸溶液分别与足量锌反应,醋酸产生的氢气多 |
| C.等体积、等浓度的盐酸和醋酸分别与相同大小的锌粒反应,醋酸初始反应速率快 |
| D.使用pH试纸测定溶液的pH时,若先润湿,则测得溶液的pH一定有误差 |
您最近一年使用:0次
名校
解题方法
8 . I.图中A、B、C、D、E和F均含有同一种元素,其中C为有磁性的黑色晶体,B常用于油漆和涂料,D为红褐色沉淀物,在一定条件下相互转化关系如图(部分物质略去)。回答下列问题:
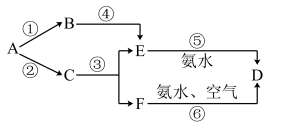
(1)B的化学式___________
(2)反应③的离子方程式___________
(3)F中加入氨水的现象(在空气中进行)___________ ,此过程中涉及到的两个反应的离子方程式___________ ; ___________
(4)在E的溶液中滴入KSCN溶液的现象___________
II.某溶液只可能含有 Fe3+、Mg2+、Cu2+、NH 、Al3+、Cl-、OH-、CO
、Al3+、Cl-、OH-、CO 、K+ 中的一种或几种,向该溶液中缓缓加入NaOH溶液,有刺激性气味的气体放出和白色沉淀产生,继续加入NaOH溶液至过量,沉淀部分溶解,由此可知:
、K+ 中的一种或几种,向该溶液中缓缓加入NaOH溶液,有刺激性气味的气体放出和白色沉淀产生,继续加入NaOH溶液至过量,沉淀部分溶解,由此可知:
(5)该溶液一定含有的离子是___________
(6)无法确定是否含有的离子是___________

(1)B的化学式
(2)反应③的离子方程式
(3)F中加入氨水的现象(在空气中进行)
(4)在E的溶液中滴入KSCN溶液的现象
II.某溶液只可能含有 Fe3+、Mg2+、Cu2+、NH
 、Al3+、Cl-、OH-、CO
、Al3+、Cl-、OH-、CO 、K+ 中的一种或几种,向该溶液中缓缓加入NaOH溶液,有刺激性气味的气体放出和白色沉淀产生,继续加入NaOH溶液至过量,沉淀部分溶解,由此可知:
、K+ 中的一种或几种,向该溶液中缓缓加入NaOH溶液,有刺激性气味的气体放出和白色沉淀产生,继续加入NaOH溶液至过量,沉淀部分溶解,由此可知:(5)该溶液一定含有的离子是
(6)无法确定是否含有的离子是
您最近一年使用:0次
2023-03-21更新
|
132次组卷
|
3卷引用:四川省眉山市仁寿县第一中学2022-2023学年高一下学期3月月考化学试题
解题方法
9 . 某溶液Q中含有如表所示离子中的5种离子,且离子浓度均为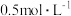 (不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。
(不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。
已知 在酸性溶液中会发生歧化反应。请回答下列问题:
在酸性溶液中会发生歧化反应。请回答下列问题:
(1)由“加入足量稀氢溴酸,……”“反应前后阴离子种类不变”推知:溶液Q中一定不含的阴离子有_______ (填数字)种。
(2)综合推断,溶液Q中一定含有的阳离子有_______ (填离子符号,下同)。产生气体R的反应中,原溶液中过量的离子是_______ 。
(3)一定量溶液Q与氯气缓慢反应,反应后的溶液分为3份,分别进行以下操作,实验现象如图:

①铜粉参与的反应中,氧化产物是_______ (填离子符号)。
②当 时,向溶液Q中通入氯气时发生反应的离子方程式为
时,向溶液Q中通入氯气时发生反应的离子方程式为_______ ;假设不考虑 与
与 的反应,则根据实验现象可推算出V的范围为
的反应,则根据实验现象可推算出V的范围为_______ 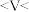
_______ 。
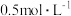 (不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。
(不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。| 阳离子 | 阴离子 |
  |   |
 在酸性溶液中会发生歧化反应。请回答下列问题:
在酸性溶液中会发生歧化反应。请回答下列问题:(1)由“加入足量稀氢溴酸,……”“反应前后阴离子种类不变”推知:溶液Q中一定不含的阴离子有
(2)综合推断,溶液Q中一定含有的阳离子有
(3)一定量溶液Q与氯气缓慢反应,反应后的溶液分为3份,分别进行以下操作,实验现象如图:

①铜粉参与的反应中,氧化产物是
②当
 时,向溶液Q中通入氯气时发生反应的离子方程式为
时,向溶液Q中通入氯气时发生反应的离子方程式为 与
与 的反应,则根据实验现象可推算出V的范围为
的反应,则根据实验现象可推算出V的范围为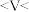
您最近一年使用:0次
名校
解题方法
10 . 某强酸性透明溶液中可能含有 、
、 、
、 、
、 、
、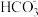 、
、 中的几种。为了确定其组成,现做以下实验:
中的几种。为了确定其组成,现做以下实验:
①取该溶液 ,加入足量的
,加入足量的 溶液,加热,得到标况下
溶液,加热,得到标况下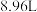 气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到
气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到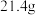 固体。
固体。
②向上述滤液中加入足量的 溶液,产生白色沉淀,过滤,洗涤,干燥得到
溶液,产生白色沉淀,过滤,洗涤,干燥得到 固体。
固体。
已知:含 的盐与强碱混合后,加热可以产生
的盐与强碱混合后,加热可以产生 。
。
(1)该溶液中一定含有___________ ;可能含有___________ ,可以用定性分析操作___________ 来进行检验。若含有,现象是:___________ 。
(2)计算:该 溶液中,若
溶液中,若 ,则
,则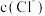
___________ 。
(3)已知 与
与 在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式
在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式___________ ;当某溶液 中大量存在
中大量存在 时,
时, 溶液中不可能大量含有
溶液中不可能大量含有___________ 。
a. b.
b.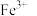 c.
c. d.
d. e.
e.
 、
、 、
、 、
、 、
、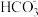 、
、 中的几种。为了确定其组成,现做以下实验:
中的几种。为了确定其组成,现做以下实验:①取该溶液
 ,加入足量的
,加入足量的 溶液,加热,得到标况下
溶液,加热,得到标况下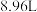 气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到
气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到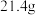 固体。
固体。②向上述滤液中加入足量的
 溶液,产生白色沉淀,过滤,洗涤,干燥得到
溶液,产生白色沉淀,过滤,洗涤,干燥得到 固体。
固体。已知:含
 的盐与强碱混合后,加热可以产生
的盐与强碱混合后,加热可以产生 。
。(1)该溶液中一定含有
(2)计算:该
 溶液中,若
溶液中,若 ,则
,则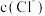
(3)已知
 与
与 在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式
在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式 中大量存在
中大量存在 时,
时, 溶液中不可能大量含有
溶液中不可能大量含有a.
 b.
b.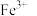 c.
c. d.
d. e.
e.
您最近一年使用:0次
2021-11-21更新
|
263次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2021-2022学年高一上学期期中联考化学试题



