解题方法
1 .  是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:

(1) 的名称是
的名称是___________ ,若A是一种纯净物,则A的化学式为___________ 。
(2)“还原1”中应充分搅拌,好处是___________ ,反应中消耗的氧化剂与还原剂物质的量之比为___________ ,“还原2”反应的离子方程式为___________ 。
 是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
(1)
 的名称是
的名称是(2)“还原1”中应充分搅拌,好处是
您最近一年使用:0次
2 . 钯( )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
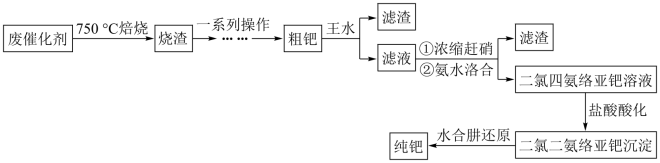
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量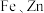 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是_______ 。
(2)“一系列操作”包括向烧渣中加入 ,目的是将
,目的是将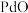 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:___________ 。
(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸( )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
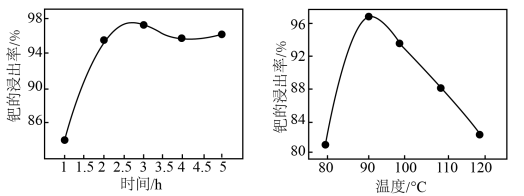
的物质的量之比为_______ 。钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为_______ 。
(4)“氨水络合”时需要控制好溶液的 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为______ (保留三位有效数字)。(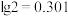 )
)
(5)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
______ 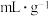 ,氢气的浓度
,氢气的浓度
______ (保留小数点后两位)。(吸附容量 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为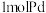 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
 )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量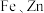 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是
(2)“一系列操作”包括向烧渣中加入
 ,目的是将
,目的是将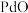 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(
 )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
的物质的量之比为
(4)“氨水络合”时需要控制好溶液的
 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为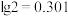 )
)(5)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
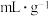 ,氢气的浓度
,氢气的浓度
 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为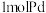 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
您最近一年使用:0次
解题方法
3 . 除了上面的金属钠之外,白风还发现了以前一位学弟留下的实验报告。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为___________ 。
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为___________ 。
(3)若mn = 5,则反应中转移的电子数量最小为___________ 。
(4)若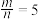 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为___________ 。
(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中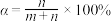 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
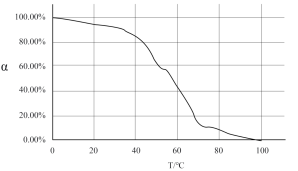
Ⅰ.由图像我们可以得出的结论是:______________________ 。
Ⅱ.试推测为什么图像会有这种趋势:______________________ 。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为
(3)若mn = 5,则反应中转移的电子数量最小为
(4)若
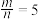 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中
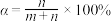 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
Ⅰ.由图像我们可以得出的结论是:
Ⅱ.试推测为什么图像会有这种趋势:
您最近一年使用:0次
4 . 高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ:在用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:
①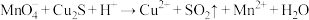 (未配平)
(未配平)
②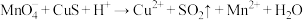 (未配平)
(未配平)
(1)下列关于反应①的说法中错误的是___________ (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下) ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mol
d.还原性的强弱关系是: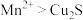
Ⅱ:在稀硫酸中, 与也能发生氧化还原反应。
与也能发生氧化还原反应。
(2)配平 与
与 反应的离子方程式:
反应的离子方程式:___________

(3)欲配制480mL0.1mol/L 溶液,需称取
溶液,需称取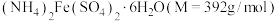 的质量为
的质量为___________ g,需要的玻璃仪器有___________ 。
Ⅲ:实验室可由软锰矿(主要成分为 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和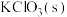 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:
(4)用软锰矿制备 的化学方程式是:
的化学方程式是:___________ 。
(5) 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为___________ 。
Ⅰ:在用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:①
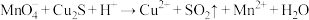 (未配平)
(未配平)②
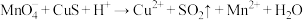 (未配平)
(未配平)(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下)
 ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mold.还原性的强弱关系是:
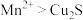
Ⅱ:在稀硫酸中,
 与也能发生氧化还原反应。
与也能发生氧化还原反应。(2)配平
 与
与 反应的离子方程式:
反应的离子方程式:
(3)欲配制480mL0.1mol/L
 溶液,需称取
溶液,需称取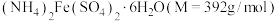 的质量为
的质量为Ⅲ:实验室可由软锰矿(主要成分为
 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和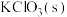 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:(4)用软锰矿制备
 的化学方程式是:
的化学方程式是:(5)
 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
名校
5 . 利用NaClO和尿素[CO(NH2)2]反应制备 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示:
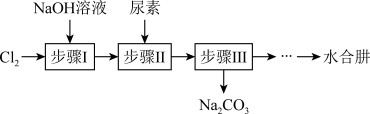
已知:①氯气与烧碱溶液的反应是放热反应,温度过高会有副产物 生成;
生成;
② 有强还原性,能与NaClO剧烈反应生成
有强还原性,能与NaClO剧烈反应生成 。下列说法错误的是
。下列说法错误的是
 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示:
已知:①氯气与烧碱溶液的反应是放热反应,温度过高会有副产物
 生成;
生成;②
 有强还原性,能与NaClO剧烈反应生成
有强还原性,能与NaClO剧烈反应生成 。下列说法错误的是
。下列说法错误的是| A.步骤Ⅰ中应该避免温度过高 |
B.步骤Ⅰ制备NaClO溶液时,若溶液中NaClO与副产物 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 |
| C.已知尿素[CO(NH2)2]中碳的化合价:+4,氧的化合价:-2,氢的化合价:+1,步骤Ⅱ生成水合肼反应中NaClO作为氧化剂 |
| D.步骤Ⅱ中可将尿素水溶液逐滴滴入NaClO碱性溶液中 |
您最近一年使用:0次
2023-11-09更新
|
376次组卷
|
3卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
6 . 工业上一种制备 方法的化学原理可表示为:
方法的化学原理可表示为: (未配平),已知每生成2个
(未配平),已知每生成2个 ,同时消耗3个
,同时消耗3个 ,则
,则 中x的值为
中x的值为
 方法的化学原理可表示为:
方法的化学原理可表示为: (未配平),已知每生成2个
(未配平),已知每生成2个 ,同时消耗3个
,同时消耗3个 ,则
,则 中x的值为
中x的值为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2023-10-23更新
|
754次组卷
|
6卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
7 . 已知工业上制备氧缺位铁酸盐 部分流程如图,该方法可实现硫、氮氧化合物的废气利用。下列有关说法错误的是
部分流程如图,该方法可实现硫、氮氧化合物的废气利用。下列有关说法错误的是
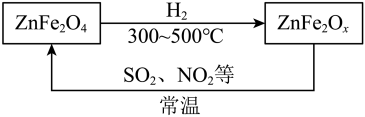
 部分流程如图,该方法可实现硫、氮氧化合物的废气利用。下列有关说法错误的是
部分流程如图,该方法可实现硫、氮氧化合物的废气利用。下列有关说法错误的是
A.若 与 与 以个数比 以个数比 发生反应,则 发生反应,则 |
B. 与 与 的反应要在无氧条件下进行 的反应要在无氧条件下进行 |
C.若使1个 完全转化为 完全转化为 ,需失去 ,需失去 个 个 |
D. 的还原性强于 的还原性强于 |
您最近一年使用:0次
2023-10-20更新
|
396次组卷
|
3卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
8 . 城市污水中含有一定量的 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是
 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是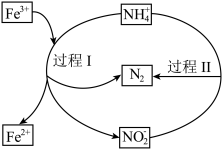
A.“过程Ⅰ”中 为催化剂 为催化剂 |
B. 的氧化性强于 的氧化性强于 |
C.“过程Ⅱ”中氧化产物和还原产物的质量之比为 |
D.“过程Ⅰ”中 和 和 的物质的量之比为 的物质的量之比为 ,则氧化剂与还原剂物质的量之比为 ,则氧化剂与还原剂物质的量之比为 |
您最近一年使用:0次
2023-09-23更新
|
581次组卷
|
10卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题湘豫名校联考2023-2024学年高三上学期一轮诊断化学试题河南省信阳市信阳高级中学2024届高三上学期9月一模化学试题山东省滨州市2023-2024学年高三上学期11月期中考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期10月月考化学试题(已下线)选择题11-15江西省赣州市信丰中学2023-2024学年高一上学期11月月考化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题(已下线)选择题6-10河南省洛阳市宜阳县第一高级中学2023-2024学年高一上学期(研学班)期末考试化学试卷
9 . 三草酸合铁酸钾是制备负载型活性铁催化剂的主要原料,该配合物在光照下易分解: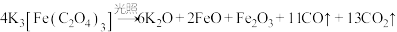 ,下列说法不正确的是
,下列说法不正确的是
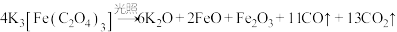 ,下列说法不正确的是
,下列说法不正确的是A.反应物中 元素只体现氧化性, 元素只体现氧化性, 元素既体现氧化性又体现还原性 元素既体现氧化性又体现还原性 |
B.氧化产物和还原产物的物质的量之比为 |
C.若有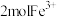 被还原,则被还原的 被还原,则被还原的 为6mol 为6mol |
D.每生成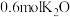 ,转移电子数为 ,转移电子数为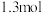 |
您最近一年使用:0次
2023-08-08更新
|
293次组卷
|
2卷引用:甘肃省天水市2023-2024学年高一上学期10月份化学竞赛试卷
解题方法
10 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为_______ 。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_______ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是_______ mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
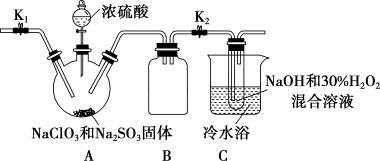
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:_______ 。
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是_______ 。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是
您最近一年使用:0次



