名校
解题方法
1 . 1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V形,键角116.5o,与SO2近似,三个原子以一个O原子为中心,与另外两个O原子分别构成一个极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个大π键——三个O原子均等地享有这4个电子。在1.01×105Pa,273K时,O3在催化剂作用下能迅速转化为O2,当生成该状态下22.4L O2时,转移电子数的物质的量为
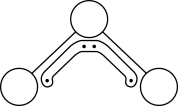
| A.1 mol | B.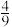 mol mol | C.0 mol | D.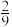 mol mol |
您最近半年使用:0次
名校
解题方法
2 . 将等物质的量的铁和铜的混合物24 g与600 mL稀硝酸恰好完全反应,生成NO 6.72 L(标准状况 ,向反应后的溶液中加入1mol/LNaOH溶液使金属离子恰好沉淀,过滤。下列有关说法正确的是
,向反应后的溶液中加入1mol/LNaOH溶液使金属离子恰好沉淀,过滤。下列有关说法正确的是
 ,向反应后的溶液中加入1mol/LNaOH溶液使金属离子恰好沉淀,过滤。下列有关说法正确的是
,向反应后的溶液中加入1mol/LNaOH溶液使金属离子恰好沉淀,过滤。下列有关说法正确的是| A.混合物溶解后的溶液中c(Fe3+):c(Fe2+) = 1:2 |
| B.需加入NaOH溶液600 mL |
| C.最后所得沉淀在空气中充分加热可得固体32 g |
| D.稀硝酸的物质的量浓度是1 mol/L |
您最近半年使用:0次
3 . 新冠肺炎疫情仍在全球肆虐,消毒消杀是做好疫情防控的一项关键性工作。ClO2、84消毒液等含氯消毒剂和臭氧等活性氧消毒剂均是应用广泛的消毒试剂。工业上制取ClO2的化学反应为:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列说法正确的是
| A.SO2在反应中得到电子 |
| B.NaClO3是氧化剂,在该反应中发生氧化反应 |
| C.氧化产物和还原产物的物质的量之比为:1:2 |
| D.生成224 mL ClO2时转移电子数为0.01NA |
您最近半年使用:0次
名校
解题方法
4 . 混合气体中含NO2、NH3和O2,它们恰好都完全反应,生成N2和H2O。那么在等温、等压条件下,VNO2∶VNH3∶VO2的比值不可能为
| A.2∶4∶1 | B.2∶1∶2 | C.1∶2∶1 | D.1∶4∶3 |
您最近半年使用:0次
解题方法
5 .  是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:

(1) 的名称是
的名称是___________ ,若A是一种纯净物,则A的化学式为___________ 。
(2)“还原1”中应充分搅拌,好处是___________ ,反应中消耗的氧化剂与还原剂物质的量之比为___________ ,“还原2”反应的离子方程式为___________ 。
 是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
(1)
 的名称是
的名称是(2)“还原1”中应充分搅拌,好处是
您最近半年使用:0次
解题方法
6 . 锰是冶金工业中不可缺少的添加剂,它的作用是增加合金金属材料的硬度、韧性、耐磨性和耐腐性,应用最广泛的有不锈钢、高锰钢、锰铝合金等。位于遵义市红花岗区坪桥工业园区的遵义天磁锰业集团有限公司就是一家电解锰公司;以碳酸锰为主要原料,其中含有少量铁、铝、钙、硅的氧化物或硫化物等杂质,以下是电解锰的简化工艺流程图:

(1)粉碎的目的___________ 。
(2)写出浸出时主要的离子反应___________ ,同时会产生的有毒气体是___________ 。
(3)加双氧水的作用方程式表示出来___________ 。
(4)加入氨水的作用是___________ ,除铁的离子反应___________ 。
(5)电解制锰的电极反应___________ ,当外电路转移2mol电子时,生成的气体是___________ ,在标准状况下的体积为___________ L,阳极液中产生的___________ 可循环使用。

(1)粉碎的目的
(2)写出浸出时主要的离子反应
(3)加双氧水的作用方程式表示出来
(4)加入氨水的作用是
(5)电解制锰的电极反应
您最近半年使用:0次
7 . 钯( )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量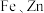 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
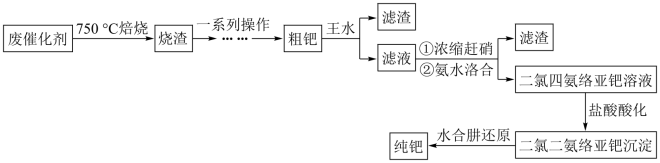
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是_______ 。
(2)“一系列操作”包括向烧渣中加入 ,目的是将
,目的是将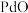 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:___________ 。
(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(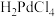 )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
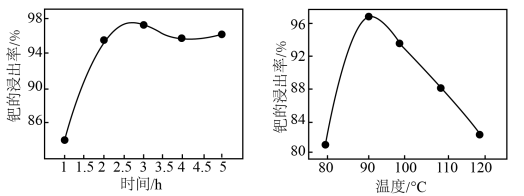
的物质的量之比为_______ 。钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为_______ 。
(4)“氨水络合”时需要控制好溶液的 ,已知常温下,
,已知常温下,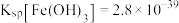 ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为______ (保留三位有效数字)。(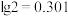 )
)
(5)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
______ 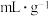 ,氢气的浓度
,氢气的浓度
______ (保留小数点后两位)。(吸附容量 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为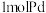 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
 )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量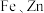 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是
(2)“一系列操作”包括向烧渣中加入
 ,目的是将
,目的是将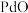 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(
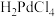 )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
的物质的量之比为
(4)“氨水络合”时需要控制好溶液的
 ,已知常温下,
,已知常温下,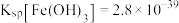 ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为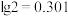 )
)(5)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
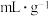 ,氢气的浓度
,氢气的浓度
 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为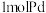 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
您最近半年使用:0次
解题方法
8 . 除了上面的金属钠之外,白风还发现了以前一位学弟留下的实验报告。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为___________ 。
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为___________ 。
(3)若mn = 5,则反应中转移的电子数量最小为___________ 。
(4)若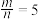 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为___________ 。
(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中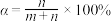 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
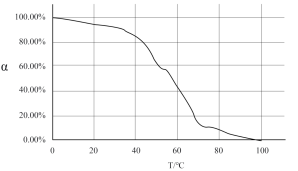
Ⅰ.由图像我们可以得出的结论是:______________________ 。
Ⅱ.试推测为什么图像会有这种趋势:______________________ 。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为
(3)若mn = 5,则反应中转移的电子数量最小为
(4)若
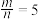 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中
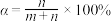 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
Ⅰ.由图像我们可以得出的结论是:
Ⅱ.试推测为什么图像会有这种趋势:
您最近半年使用:0次
9 . 高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ:在用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:
①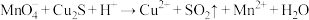 (未配平)
(未配平)
②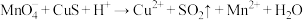 (未配平)
(未配平)
(1)下列关于反应①的说法中错误的是___________ (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下) ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mol
d.还原性的强弱关系是: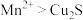
Ⅱ:在稀硫酸中, 与也能发生氧化还原反应。
与也能发生氧化还原反应。
(2)配平 与
与 反应的离子方程式:
反应的离子方程式:___________

(3)欲配制480mL0.1mol/L 溶液,需称取
溶液,需称取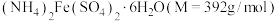 的质量为
的质量为___________ g,需要的玻璃仪器有___________ 。
Ⅲ:实验室可由软锰矿(主要成分为 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和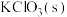 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:
(4)用软锰矿制备 的化学方程式是:
的化学方程式是:___________ 。
(5) 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为___________ 。
Ⅰ:在用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:①
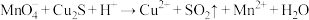 (未配平)
(未配平)②
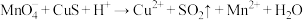 (未配平)
(未配平)(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下)
 ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mold.还原性的强弱关系是:
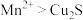
Ⅱ:在稀硫酸中,
 与也能发生氧化还原反应。
与也能发生氧化还原反应。(2)配平
 与
与 反应的离子方程式:
反应的离子方程式:
(3)欲配制480mL0.1mol/L
 溶液,需称取
溶液,需称取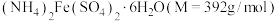 的质量为
的质量为Ⅲ:实验室可由软锰矿(主要成分为
 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和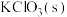 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:(4)用软锰矿制备
 的化学方程式是:
的化学方程式是:(5)
 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为
您最近半年使用:0次
名校
10 . 利用NaClO和尿素[CO(NH2)2]反应制备 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示:
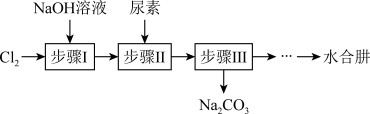
已知:①氯气与烧碱溶液的反应是放热反应,温度过高会有副产物 生成;
生成;
②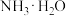 有强还原性,能与NaClO剧烈反应生成
有强还原性,能与NaClO剧烈反应生成 。下列说法错误的是
。下列说法错误的是
 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示:
已知:①氯气与烧碱溶液的反应是放热反应,温度过高会有副产物
 生成;
生成;②
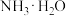 有强还原性,能与NaClO剧烈反应生成
有强还原性,能与NaClO剧烈反应生成 。下列说法错误的是
。下列说法错误的是| A.步骤Ⅰ中应该避免温度过高 |
B.步骤Ⅰ制备NaClO溶液时,若溶液中NaClO与副产物 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 |
| C.已知尿素[CO(NH2)2]中碳的化合价:+4,氧的化合价:-2,氢的化合价:+1,步骤Ⅱ生成水合肼反应中NaClO作为氧化剂 |
| D.步骤Ⅱ中可将尿素水溶液逐滴滴入NaClO碱性溶液中 |
您最近半年使用:0次
2023-11-09更新
|
361次组卷
|
3卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试



