1 . 亚氯酸钠( )具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的
)具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的 易爆炸.下列说法错误的是
易爆炸.下列说法错误的是
 )具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的
)具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的 易爆炸.下列说法错误的是
易爆炸.下列说法错误的是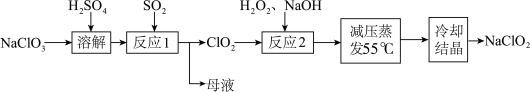
A.“反应1”中 是还原产物,母液中主要成分是 是还原产物,母液中主要成分是 |
B.“反应1”需要通入 稀释 稀释 ,以防发生爆炸 ,以防发生爆炸 |
C.“反应2”中,氧化剂和还原剂的物质的量之比为 |
D.若还原产物均为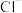 时, 时, 的氧化能力是等质量 的氧化能力是等质量 的2.5倍 的2.5倍 |
您最近半年使用:0次
2 . 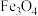 磁材料应用广泛,制备流程如图。下列说法错误的是
磁材料应用广泛,制备流程如图。下列说法错误的是
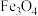 磁材料应用广泛,制备流程如图。下列说法错误的是
磁材料应用广泛,制备流程如图。下列说法错误的是
| A.“产物1”需要密封保存防止氧化 |
B.“釜B”中主要反应的化学方程式为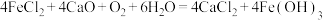 |
C.“产物1”与“产物2”中参与生成 反应的物质的物质的量之比为2:1 反应的物质的物质的量之比为2:1 |
| D.“分散剂”可破坏形成的胶体来促进氧化 |
您最近半年使用:0次
3 . NH4NO3受撞击时会发生爆炸: 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A. 溶液中含 溶液中含 数目为 数目为 |
B.1molN2中含 键数目为 键数目为 |
C.标准状况下,22.4LH2O中含电子数为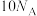 |
D.每生成0.2molNO2,该反应中转移电子数为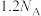 |
您最近半年使用:0次
名校
解题方法
4 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: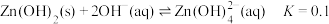 ;
;
②室温下,部分离子浓度的对数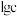 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物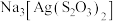 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: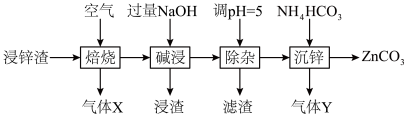
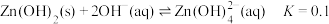 ;
;②室温下,部分离子浓度的对数
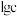 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):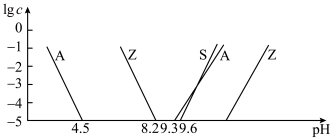
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
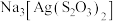 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次
昨日更新
|
108次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
解题方法
5 . 以大洋锰结核(主要由 和铁氧化物组成,还含有
和铁氧化物组成,还含有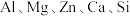 等元素)为原料制备
等元素)为原料制备 及
及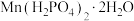 的工艺流程如下:
的工艺流程如下: 范围如下:
范围如下:
② 时,
时,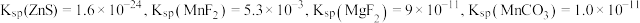 。
。
回答下列问题:
(1)锰元素在元素周期表中的位置为___________ 。
(2)“浸取”时,有副产物 生成。该副反应过程中氧化剂与还原剂的物质的量之比为
生成。该副反应过程中氧化剂与还原剂的物质的量之比为___________ 。温度对锰的浸出率、 生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为
生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为___________ 左右(填标号)。 B.
B.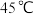 C.
C. D.
D.
(3)加氨水“调 ”时,应控制的
”时,应控制的 范围是
范围是___________ 。
(4)“净化”后,过滤出“滤渣3”,所得滤液中 的最低浓度为
的最低浓度为___________  。
。
(5)“沉锰”时,加入过量的 溶液与溶液中的
溶液与溶液中的 作用,反应的化学方程式为
作用,反应的化学方程式为___________ 。若改用加入 溶液,还会产生
溶液,还会产生 沉淀,可能的原因是:
沉淀,可能的原因是: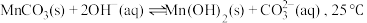 时,该反应的平衡常数的对数值
时,该反应的平衡常数的对数值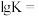
___________ (保留1位小数)。
(6)要将“溶解”后的溶液制得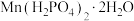 晶体,操作X为
晶体,操作X为___________ 、___________ 、过滤、洗涤、干燥。
 和铁氧化物组成,还含有
和铁氧化物组成,还含有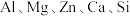 等元素)为原料制备
等元素)为原料制备 及
及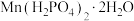 的工艺流程如下:
的工艺流程如下: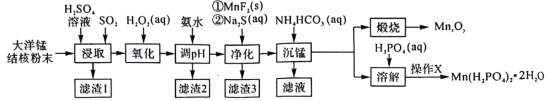
 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
完全沉淀的 | 10.2 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
 时,
时,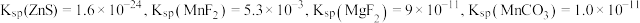 。
。回答下列问题:
(1)锰元素在元素周期表中的位置为
(2)“浸取”时,有副产物
 生成。该副反应过程中氧化剂与还原剂的物质的量之比为
生成。该副反应过程中氧化剂与还原剂的物质的量之比为 生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为
生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为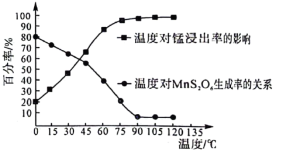
 B.
B.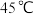 C.
C. D.
D.
(3)加氨水“调
 ”时,应控制的
”时,应控制的 范围是
范围是(4)“净化”后,过滤出“滤渣3”,所得滤液中
 的最低浓度为
的最低浓度为 。
。(5)“沉锰”时,加入过量的
 溶液与溶液中的
溶液与溶液中的 作用,反应的化学方程式为
作用,反应的化学方程式为 溶液,还会产生
溶液,还会产生 沉淀,可能的原因是:
沉淀,可能的原因是: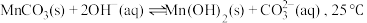 时,该反应的平衡常数的对数值
时,该反应的平衡常数的对数值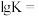
(6)要将“溶解”后的溶液制得
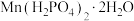 晶体,操作X为
晶体,操作X为
您最近半年使用:0次
名校
6 . 实验室可利用反应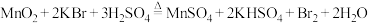 制备
制备 。设
。设 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是
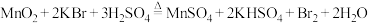 制备
制备 。设
。设 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是A.0℃、101kPa下,11.2L  所含的分子数为0.5 所含的分子数为0.5 |
B.0.1 的 的  溶液中含有的离子数为0.3 溶液中含有的离子数为0.3 |
C.常温常压下,9.8g  和9.8g 和9.8g  中含有的氧原子数均为0.4 中含有的氧原子数均为0.4 |
D.该反应中生成0.2mol  时,转移的电子数为0.2 时,转移的电子数为0.2 |
您最近半年使用:0次
7 . 二氯化二硫( )是一种常用的橡胶硫化剂,其结构如图所示。
)是一种常用的橡胶硫化剂,其结构如图所示。 极易水解:
极易水解: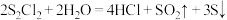 。下列说法错误的是
。下列说法错误的是
 )是一种常用的橡胶硫化剂,其结构如图所示。
)是一种常用的橡胶硫化剂,其结构如图所示。 极易水解:
极易水解: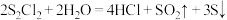 。下列说法错误的是
。下列说法错误的是
A. 中S为+1价 中S为+1价 |
B. 是由非极性键与极性键构成的极性分子 是由非极性键与极性键构成的极性分子 |
C.上述反应中 既作氧化剂又作还原剂 既作氧化剂又作还原剂 |
| D.上述反应中氧化产物与还原产物的质量比为3:1 |
您最近半年使用:0次
解题方法
8 . 酸性条件下Na2S和Na2SO3发生反应: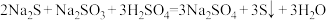 ,下列说法
,下列说法不正确 的是(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
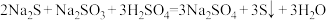 ,下列说法
,下列说法 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)A.生成24gS转移电子的数目为 | B.Na2S是还原剂,发生氧化反应 |
| C.Na2SO4是氧化产物 | D.碱性条件下S2-和 可以大量共存 可以大量共存 |
您最近半年使用:0次
9 . 某科研团队从铬钒渣中分离钒并制备Cr(OH)3的流程如下:
②Cr的最高价含氧酸根离子在酸性介质中主要以 存在,在碱性介质中主要以
存在,在碱性介质中主要以 存在。
存在。
下列说法错误的是
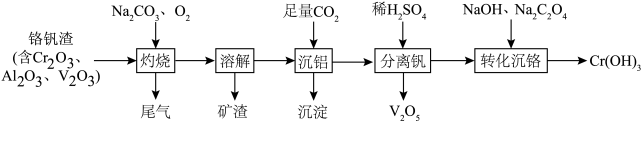
②Cr的最高价含氧酸根离子在酸性介质中主要以
 存在,在碱性介质中主要以
存在,在碱性介质中主要以 存在。
存在。下列说法错误的是
| A.“灼烧”步骤的尾气中含CO2 |
B.“沉铝”步骤的离子方程式为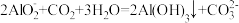 |
C.“分离钒”之后Cr元素的存在形式主要为 |
| D.“转化沉铬”步骤中氧化剂与还原剂的物质的量之比为1∶3 |
您最近半年使用:0次
7日内更新
|
247次组卷
|
2卷引用:福建省漳州市2024届高三下学期毕业班第三次质量检测三模化学试题
名校
解题方法
10 . 我国最新型055型万吨驱逐舰上使用了最新一代国产有源相控阵雷达,采用了最先进的氮化镓( )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是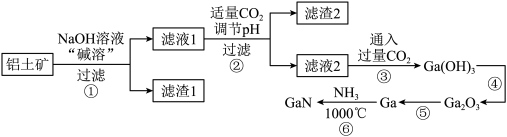
| A.可以通过粉碎铝土矿、搅拌等方法提高“碱溶”效率 |
B.由过程②、③可知,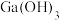 的酸性比 的酸性比 强 强 |
C.已知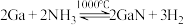 , , 与足量 与足量 反应,转移电子数为 反应,转移电子数为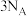 |
D.滤渣1是 ,生成滤渣2的离子方程式可能为 ,生成滤渣2的离子方程式可能为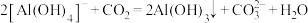 |
您最近半年使用:0次



