解题方法
1 . 工业上,常用浓氨水检验输送氯气管道是否漏气,发生反应: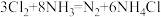 (白烟)。下列叙述错误的是
(白烟)。下列叙述错误的是
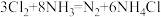 (白烟)。下列叙述错误的是
(白烟)。下列叙述错误的是A.NH3的电子式为 |
| B.1个N2分子含3个共用电子对 |
| C.NH4Cl只含共价键 |
| D.反应中每生成1molN2转移电子6mol |
您最近半年使用:0次
2 . 已知反应 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是
 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是A.转移的电子数目为 |
B. 是由非极性共价键形成的非极性分子 是由非极性共价键形成的非极性分子 |
C.参与反应的 含有孤电子对数为 含有孤电子对数为 |
| D.生成的还原产物质量为56g |
您最近半年使用:0次
解题方法
3 . 根据元素的特征完成下列问题。
I.元素A、B、J、D、E、F、G是元素周期表前四周期的常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)在下列物质中属于离子化合物的是有___________ ,仅含共价键的有___________ 。
①AF ②DF ③ ④
④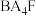
(2)E的单质与D的最高价氧化物对应水化物溶液反应的离子方程式为___________ 。
(3)B原子能与碳原子形成化学式为 的链状分子,其中所有原子都满足8电子稳定结构。
的链状分子,其中所有原子都满足8电子稳定结构。 的电子式为
的电子式为___________ 。
(4)在X中,G元素基态离子的价层电子的轨道排布式为___________ 。
Ⅱ.几种短周期元素的原子结构和性质如下所示:
(5)元素②的离子结构示意图为___________ 。
(6)元素⑦的简单氢化物与少量⑤的单质反应时,观察到有大量白烟产生,同时得到氮气。该反应中,氧化剂与还原剂的物质的量之比为___________ 。
(7)元素①和③的单质相互反应得到产物Y。用电子式表示Y 形成过程为___________ 。
I.元素A、B、J、D、E、F、G是元素周期表前四周期的常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
| A | 原子核外电子只有一种运动状态 |
| B | 简单离子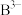 与D的离子具有相同电子排布 与D的离子具有相同电子排布 |
| J | 基态原子中s电子总数与p电子总数相等 |
| D | 元素的焰色试验呈黄色 |
| E | 基态原子价层电子排布式为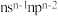 |
| F | 在基态原子的最外层上,p轨道有2个电子的自旋状态与其他电子相反 |
| G | 生活中使用最多的一种金属,其某种盐X溶液常用于刻蚀铜制印刷电路 |
①AF ②DF ③
 ④
④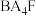
(2)E的单质与D的最高价氧化物对应水化物溶液反应的离子方程式为
(3)B原子能与碳原子形成化学式为
 的链状分子,其中所有原子都满足8电子稳定结构。
的链状分子,其中所有原子都满足8电子稳定结构。 的电子式为
的电子式为(4)在X中,G元素基态离子的价层电子的轨道排布式为
Ⅱ.几种短周期元素的原子结构和性质如下所示:
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 最外层电子数 | 6 | 1 | 1 | ||||
| 原子半径/nm | 0.074 | 0.16 | 0.152 | 0.11 | 0.099 | 0.186 | 0.075 |
| 主要化合价 | +2 | -3,+5 | -1,+7 | -3,+5 |
(6)元素⑦的简单氢化物与少量⑤的单质反应时,观察到有大量白烟产生,同时得到氮气。该反应中,氧化剂与还原剂的物质的量之比为
(7)元素①和③的单质相互反应得到产物Y。用电子式表示Y 形成过程为
您最近半年使用:0次
4 . 若 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,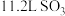 含有的分子数为 含有的分子数为 |
B.32g Cu在足量硫蒸气中完全反应失去的电子数为 |
C.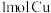 和含有 和含有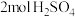 的浓硫酸反应,生成的 的浓硫酸反应,生成的 分子数目为 分子数目为 |
D.常温下,5.6g铁与硝酸反应,失去的电子数一定为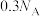 |
您最近半年使用:0次
5 . 硅单质及其化合物应用广泛。请回答下列问题:
(1)传统的无机非金属材料多为硅酸盐材料,主要包括________ 、水泥和玻璃。
(2) 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是________ (用化学方程式表示)。
(3)沙子可用作建筑材料和制玻璃的原料,下列说法不正确的是________(填字母)。
(4)硅单质可作为硅半导体材料。三氯甲硅烷( )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图:________ 。
②整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式________ ;在制备高纯硅的过程中若混入 ,可能引起的后果是
,可能引起的后果是________ 。
(5)新型陶瓷材料氮化硅( )可应用于原子反应堆,一种制备氮化硅的反应如下:
)可应用于原子反应堆,一种制备氮化硅的反应如下: 。若生成标准状况下33.6LCO时,反应过程中转移的电子数为
。若生成标准状况下33.6LCO时,反应过程中转移的电子数为________  。
。
(1)传统的无机非金属材料多为硅酸盐材料,主要包括
(2)
 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(3)沙子可用作建筑材料和制玻璃的原料,下列说法不正确的是________(填字母)。
A. 能与水反应 能与水反应 | B. 在一定条件下能与氧化钙反应 在一定条件下能与氧化钙反应 |
C. 是制作光导纤维的主要原料 是制作光导纤维的主要原料 | D. 能与稀硫酸反应 能与稀硫酸反应 |
(4)硅单质可作为硅半导体材料。三氯甲硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图: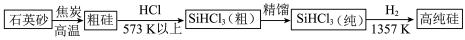
②整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式 ,可能引起的后果是
,可能引起的后果是(5)新型陶瓷材料氮化硅(
 )可应用于原子反应堆,一种制备氮化硅的反应如下:
)可应用于原子反应堆,一种制备氮化硅的反应如下: 。若生成标准状况下33.6LCO时,反应过程中转移的电子数为
。若生成标准状况下33.6LCO时,反应过程中转移的电子数为 。
。
您最近半年使用:0次
名校
解题方法
6 . 已知反应: ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是
 ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是A.转移电子数为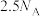 |
B.断裂的 键数为 键数为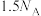 |
| C.还原产物比氧化产物多0.5mol |
D.将生成物配制成1L水溶液,溶液中 |
您最近半年使用:0次
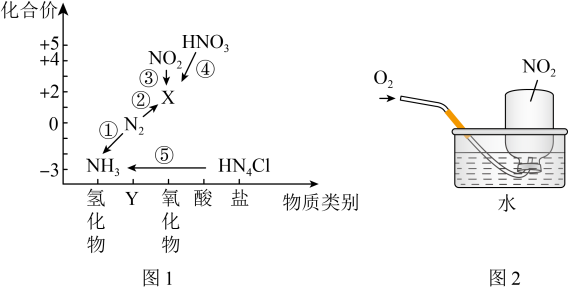
7 . 氮元素是高中化学学习的一种重要非金属元素,其价类二维图如图1所示。________ ,反应①~⑤中不属于氧化还原反应的是________ (填序号)。
(2)反应①中每消耗1mol氢气,转移电子________ mol。
(3)除去X中混有的少量 的方法是
的方法是________ 。
(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式________ 。
(5)用集气瓶收集 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。
①写出该过程总反应的化学方程式________ 。该实验对工业上生产硝酸的启示是________ 。
②假设该实验条件下,气体摩尔体积为 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为________ mol/L。
(2)反应①中每消耗1mol氢气,转移电子
(3)除去X中混有的少量
 的方法是
的方法是(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式
(5)用集气瓶收集
 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。①写出该过程总反应的化学方程式
②假设该实验条件下,气体摩尔体积为
 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
您最近半年使用:0次
8 . 聚合硫酸铁是一种新型高效净水剂。以黄铁矿(主要成分: ,铁的化合价为
,铁的化合价为 价)烧渣(主要成分为
价)烧渣(主要成分为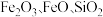 等)为原料制取聚合硫酸铁(铁的化合价为
等)为原料制取聚合硫酸铁(铁的化合价为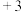 价)的实验步骤如图:
价)的实验步骤如图:
(1)“煅烧”过程发生反应的氧化产物是______ 。
(2)写出“酸浸”过程中发生反应的离子方程式______ 。
(3)“氧化”过程中先产生无色气体,最终变成红棕色气体,写出加入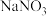 产生无色气体反应的离子方程式
产生无色气体反应的离子方程式_______ ,若用 代替
代替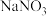 达到相同氧化效果,消耗
达到相同氧化效果,消耗 和
和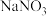 的物质的量之比
的物质的量之比_____ 。
(4)为确定产品是否合格,需测定聚合硫酸铁中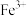 和
和 的物质的量之比,测定时需要的试剂为______(填写序号)。
的物质的量之比,测定时需要的试剂为______(填写序号)。
 ,铁的化合价为
,铁的化合价为 价)烧渣(主要成分为
价)烧渣(主要成分为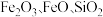 等)为原料制取聚合硫酸铁(铁的化合价为
等)为原料制取聚合硫酸铁(铁的化合价为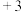 价)的实验步骤如图:
价)的实验步骤如图: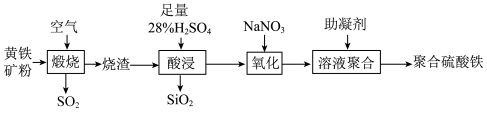
(1)“煅烧”过程发生反应的氧化产物是
(2)写出“酸浸”过程中发生反应的离子方程式
(3)“氧化”过程中先产生无色气体,最终变成红棕色气体,写出加入
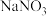 产生无色气体反应的离子方程式
产生无色气体反应的离子方程式 代替
代替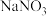 达到相同氧化效果,消耗
达到相同氧化效果,消耗 和
和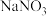 的物质的量之比
的物质的量之比(4)为确定产品是否合格,需测定聚合硫酸铁中
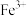 和
和 的物质的量之比,测定时需要的试剂为______(填写序号)。
的物质的量之比,测定时需要的试剂为______(填写序号)。A.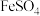 | B. | C. | D. |
您最近半年使用:0次
9 . 海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。下列说法不正确的是
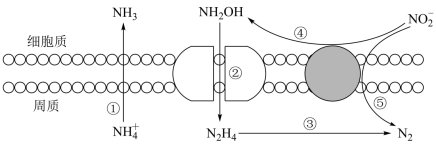
| A.以上六种含氮微粒,一共呈现了氮的五种价态 |
| B.反应①~⑤中有2个非氧化还原反应 |
C.反应③中若 与 与 反应,则 反应,则 作还原剂 作还原剂 |
D.反应③和⑤若生成等质量的 ,转移的电子数一样多 ,转移的电子数一样多 |
您最近半年使用:0次
名校
解题方法
10 . 设 代表阿伏加德罗常数的值。下列关于反应:
代表阿伏加德罗常数的值。下列关于反应: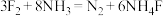 的叙述正确的是
的叙述正确的是
 代表阿伏加德罗常数的值。下列关于反应:
代表阿伏加德罗常数的值。下列关于反应: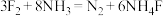 的叙述正确的是
的叙述正确的是| A.上述反应中,氧化剂与还原剂的物质的量之比为3:8 |
B. 固体中含离子数为 固体中含离子数为 |
C.14g氧化产物含孤电子对数为 |
D. 完全反应时转移电子数为 完全反应时转移电子数为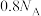 |
您最近半年使用:0次
7日内更新
|
44次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷



