名校
解题方法
1 . 设 代表阿伏加德罗常数的值。下列关于反应:
代表阿伏加德罗常数的值。下列关于反应: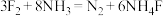 的叙述正确的是
的叙述正确的是
 代表阿伏加德罗常数的值。下列关于反应:
代表阿伏加德罗常数的值。下列关于反应: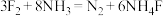 的叙述正确的是
的叙述正确的是| A.上述反应中,氧化剂与还原剂的物质的量之比为3:8 |
B. 固体中含离子数为 固体中含离子数为 |
C.14g氧化产物含孤电子对数为 |
D. 完全反应时转移电子数为 完全反应时转移电子数为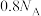 |
您最近一年使用:0次
2024-05-11更新
|
62次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
名校
解题方法
2 . 以硫铁矿(主要成分为 ,还有少量
,还有少量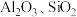 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如图所示,下列说法错误的是
的工艺流程如图所示,下列说法错误的是
 ,还有少量
,还有少量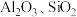 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体 的工艺流程如图所示,下列说法错误的是
的工艺流程如图所示,下列说法错误的是
A.滤渣X的成分为 |
B.“焙烧”硫铁矿的主要反应中,还原剂与氧化剂的物质的量之比为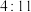 |
| C.“过滤”中分离操作所用的玻璃仪器有(普通)漏斗、玻璃棒和烧杯 |
D.“还原”中试剂Y可能为 |
您最近一年使用:0次
3 .  下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: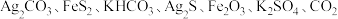 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量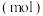 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: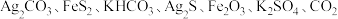 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量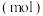 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是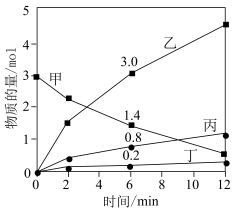
A.甲代表 ,丁为碱性氧化物 ,丁为碱性氧化物 |
B.还原产物、氧化产物的物质的量之比 |
C. 甲完全反应转移电子数为 甲完全反应转移电子数为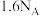 |
D.在该反应中,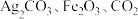 的化学计量数之比为 的化学计量数之比为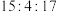 |
您最近一年使用:0次
名校
解题方法
4 . 将一定质量的铜与150mL的一定浓度的硝酸反应,铜完全溶解,产生标准状况下11.2L的NO和NO2的混合气体(不考虑NO2转化成N2O4),将生成的混合气体与5.6L标况下的氧气一起通入足量NaOH溶液中,气体恰好被吸收生成NaNO3。下列说法不正确的是
| A.铜的质量为32g |
| B.硝酸的物质的量浓度为10.0mol•L-1 |
| C.铜与硝酸反应,生成的NO和NO2体积相等 |
| D.向反应后的溶液加NaOH,使铜沉淀完全,需要NaOH的物质的量至少为1.0mol |
您最近一年使用:0次
5 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)Na2O2的电子式为_______ 。Na2O2可作供氧剂,写出Na2O2与CO2反应的化学方程式_______ 。若有1molNa2O2参加反应则转移电子的物质的量为_______ mol。
(2)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过_______ 、_______ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为_______ g。
(1)Na2O2的电子式为
(2)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为
您最近一年使用:0次
解题方法
6 . 高铁酸钾( )具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量
)具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量 杂质的铁屑原料,经过如下流程制备少量
杂质的铁屑原料,经过如下流程制备少量 。
。

(1) 中铁元素的化合价是
中铁元素的化合价是___________ 。
(2)往原料中添加过量 除去的物质为
除去的物质为___________ 。
(3)“预氧化”环节的离子方程式是___________ 。
(4)“制备 ”的反应中,还原剂和氧化剂的物质的量之比为
”的反应中,还原剂和氧化剂的物质的量之比为___________ 。
(5)“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下: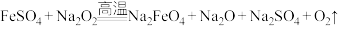 ,若反应中被氧化的
,若反应中被氧化的 与被还原的
与被还原的 之物质的量比为1∶4,请写出该反应配平后的方程式:
之物质的量比为1∶4,请写出该反应配平后的方程式:___________ 。此时,若反应产生11.2L(标准状况) ,则转移的电子为
,则转移的电子为___________ mol。
 )具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量
)具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量 杂质的铁屑原料,经过如下流程制备少量
杂质的铁屑原料,经过如下流程制备少量 。
。
(1)
 中铁元素的化合价是
中铁元素的化合价是(2)往原料中添加过量
 除去的物质为
除去的物质为(3)“预氧化”环节的离子方程式是
(4)“制备
 ”的反应中,还原剂和氧化剂的物质的量之比为
”的反应中,还原剂和氧化剂的物质的量之比为(5)“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:
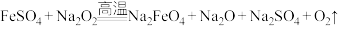 ,若反应中被氧化的
,若反应中被氧化的 与被还原的
与被还原的 之物质的量比为1∶4,请写出该反应配平后的方程式:
之物质的量比为1∶4,请写出该反应配平后的方程式: ,则转移的电子为
,则转移的电子为
您最近一年使用:0次
7 . 某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3(不溶于水)、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2.
(1)写出该反应的化学方程式:_____ 。
(2)该反应中氧化剂是_____ ,氧化产物是_____ 。
(3)产生1个O2,转移的电子的个数为_____ 个。
(4)用单线桥标出该反应中电子转移情况:_____ 。
(1)写出该反应的化学方程式:
(2)该反应中氧化剂是
(3)产生1个O2,转移的电子的个数为
(4)用单线桥标出该反应中电子转移情况:
您最近一年使用:0次
名校
解题方法
8 . 硫铁矿(含 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
(1)硫铁矿中 元素的化合价为
元素的化合价为___________ 。
(2)为了使反应I燃烧得更充分,可以采用的措施是___________ 。
(3)将A通入新制碘水中,发现溶液褪色,发生的离子反应方程式为______________________ 。
(4)下列关于C的说法正确的是___________。
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示: ,转移的电子的物质的量为
,转移的电子的物质的量为___________ 。
②脱硫过程中产生的 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式___________ 。
③从氧化还原角度分析,若要制备 应选择
应选择___________ (填字母)。
A. B.
B. C.
C. D.
D.
 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系: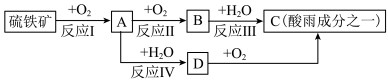
(1)硫铁矿中
 元素的化合价为
元素的化合价为(2)为了使反应I燃烧得更充分,可以采用的措施是
(3)将A通入新制碘水中,发现溶液褪色,发生的离子反应方程式为
(4)下列关于C的说法正确的是___________。
A.酸雨指的是 的雨水 的雨水 |
| B.浓硫酸可以和铁发生反应,不能用钢瓶盛装浓硫酸 |
| C.浓硫酸有强氧化性,稀硫酸没有氧化性 |
| D.稀硫酸长时间放置在空气中浓度会变高,浓硫酸长时间放置在空气中浓度会变低 |
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示:
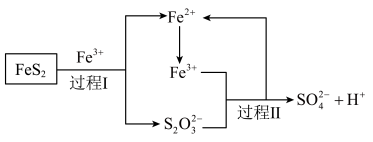
 ,转移的电子的物质的量为
,转移的电子的物质的量为②脱硫过程中产生的
 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式③从氧化还原角度分析,若要制备
 应选择
应选择A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2024-04-05更新
|
588次组卷
|
4卷引用:江西省宜春市宜丰中学2023-2024学年高一下学期3月月考化学试题
名校
9 . 向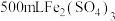 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
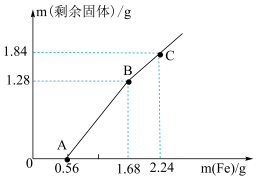
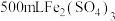 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量的关系如图所示(忽略溶液体积的变化)。下列说法中正确的是
A.AB段发生反应的离子方程式为 |
B.A点溶液中的金属阳离子为 |
C.原溶液中 与 与 的物质的量浓度之比为2:1 的物质的量浓度之比为2:1 |
D.C点溶液中溶质的物质的量浓度为 |
您最近一年使用:0次
2024-04-05更新
|
79次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
10 . 如图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。已知:A为气体,A~F都含有相同的元素。
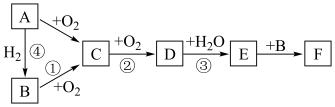
试回答下列问题。
(1)写出反应①的化学方程式:___________ 。
(2)在①②③④中属于氮的固定的是___________ (填序号)。
(3)下列说法正确的是___________。
(4)D易溶于水。常温常压下(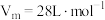 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。
①最终试管中所得E的物质的量浓度为(不考虑E的扩散)___________  。
。
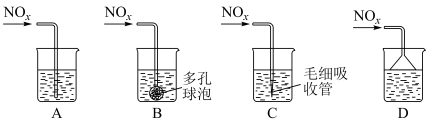
②若C、D按物质的量之比1:1被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是___________ 。为提高吸收速率与效率,最好选用___________ 装置(填序号)。
(5)工业上可用①②③由B制取E,为了提高原料的利用率并尽量减轻对环境的污染,C必须循环使用。若消耗1mol的B制取E,在该过程中至少消耗的 的物质的量为
的物质的量为___________ 。
(6)C气体与ag O2混合后通入水中,恰好被水完全吸收生成稀硝酸。若用该稀硝酸去溶解铜,假设该溶解过程只产生C气体,理论上能消耗铜的质量为___________ g。

试回答下列问题。
(1)写出反应①的化学方程式:
(2)在①②③④中属于氮的固定的是
(3)下列说法正确的是___________。
| A.通过水可以除去C中含有的少量D |
| B.物质C、D均可以用向上排空气法收集 |
| C.E的浓溶液的存放方法是保存在无色细口玻璃瓶 |
| D.物质 F 中含离子键 |
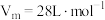 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。①最终试管中所得E的物质的量浓度为(不考虑E的扩散)
 。
。②若C、D按物质的量之比1:1被
 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是
(5)工业上可用①②③由B制取E,为了提高原料的利用率并尽量减轻对环境的污染,C必须循环使用。若消耗1mol的B制取E,在该过程中至少消耗的
 的物质的量为
的物质的量为(6)C气体与ag O2混合后通入水中,恰好被水完全吸收生成稀硝酸。若用该稀硝酸去溶解铜,假设该溶解过程只产生C气体,理论上能消耗铜的质量为
您最近一年使用:0次



