名校
1 . 如图是氮元素的各种价态与物质类别的对应关系:_____ 。从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有_______ 。
(2)实验室将浓氨水加入生石灰中可以快速制取NH3的化学方程式为_________ 。
(3)浓硝酸、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应使用___________ 。
(4)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_____________ 。

(2)实验室将浓氨水加入生石灰中可以快速制取NH3的化学方程式为
(3)浓硝酸、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应使用
(4)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
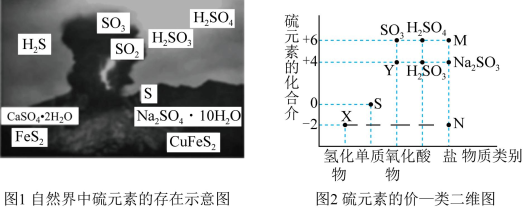
(1)图1中与图2中M、N对应的物质分别是____ 、____ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为____ 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为____ 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
(4)实验①③研究的是____ 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=____ 。
(6)实验①②研究的是____ 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起____ 作用。

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为
II.为探究影响H2O2分解速率的因素,设计如表实验:
| 编号 | 温度 | c(H2O2)/mol·L−1 | V(H2O2)/mL | 催化剂 |
| ① | 20℃ | 0.4 | 10 | 无 |
| ② | 20℃ | 0.8 | 10 | 无 |
| ③ | 30℃ | 0.4 | 10 | 无 |
| ④ | 30℃ | 0.4 | 10 | MnO2 |
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=
(6)实验①②研究的是
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起
您最近一年使用:0次
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
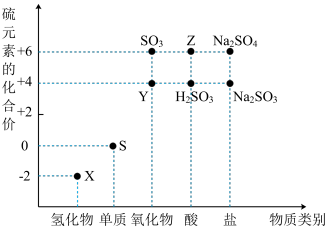
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
2021-04-25更新
|
418次组卷
|
14卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题
【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题
名校
4 . 中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途。下图是利用工业废铁屑生产纳米磁性氧化铁的流程:

下列说法正确的是

下列说法正确的是
| A.若生产中不通入N2,暴露在空气中生产,也能得到高纯度产品 |
| B.溶液浸泡是为了除去废铁屑表面的油污 |
C.加适量的H2O2的反应: |
| D.溶液A中Fe2+和Fe3+的物质的量比为2:1 |
您最近一年使用:0次
2022-01-10更新
|
188次组卷
|
3卷引用:黑龙江省佳木斯市第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
5 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
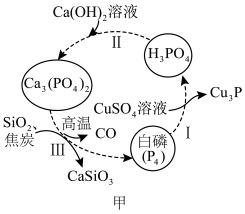
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为___________ ,过程Ⅲ的化学方程式为___________ 。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:
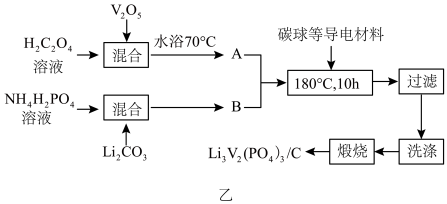
①向复合材料中加入碳单质的作用是___________ 。
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为___________ 。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,___________ ,得到LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤、洗涤、干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用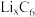 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为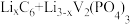 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为___________ 。
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:

①向复合材料中加入碳单质的作用是
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用
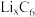 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为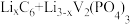 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
您最近一年使用:0次
2022-02-22更新
|
824次组卷
|
6卷引用:黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题
黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题河北省衡水中学2021-2022学年高三上学期五调考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)河北省新乐市第一中学2023-2024学年上学期高三第一次月考化学试题
名校
解题方法
6 . 下表为元素周期表的一部分,请回答有关问题:
(1)已知元素⑩的一种核素,其中子数为45,用原子符号表示该核素为_____________ 。
(2)由元素②和④形成的三核分子的结构式为_________________ 。
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程_________________________________ 。
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为______ (填“离子键”、“极性键”或“非极性键”), ④和⑦的氢化物稳定性较强的是__________ 、沸点较高的是_________ (填化学式)⑧和⑩的氢化物还原性较强的是_______ (填化学式)。
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是_________ (用离子符号表示);元素⑨的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为__________ 。
(6)铍和⑥二者的单质、化合物均具有相似的化学性质,写出BeCl2溶液与Na2BeO2的水溶液混合的化学方程式__________________________________________________________ 。
(7)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2。该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是_______________________________________________ (元素X请用具体元素符号表示)。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)由元素②和④形成的三核分子的结构式为
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是
(6)铍和⑥二者的单质、化合物均具有相似的化学性质,写出BeCl2溶液与Na2BeO2的水溶液混合的化学方程式
(7)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2。该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是
您最近一年使用:0次
名校
7 . 化工产品中,含氯物质众多,其用途广泛。回答下列问题:
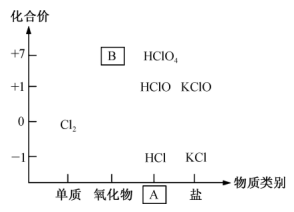
(1)如图为氯及其化合物的“价一类”二维图。缺失的类别A为______ 、物质B为______ (填化学式)。
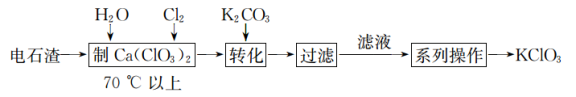
(2)电石渣[主要成分为 ]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取
]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取 的工艺流程如图所示:
的工艺流程如图所示:
已知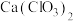 易溶于水。
易溶于水。
①工业生产电石的反应为 ,该反应中还原剂为
,该反应中还原剂为______ 。
②流程中“制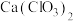 ”的化学方程式为
”的化学方程式为______ ;“转化”发生反应的离子方程式为______ 。
③上述流程中所用 是用
是用 与浓盐酸反应制得。该反应的离子方程式是
与浓盐酸反应制得。该反应的离子方程式是______ ,其中盐酸体现的性质为______ 性和______ 性。下列发生装置可用于上述方法制备 的是
的是______ (填字母)。

(1)如图为氯及其化合物的“价一类”二维图。缺失的类别A为

(2)电石渣[主要成分为
 ]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取
]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取 的工艺流程如图所示:
的工艺流程如图所示:
已知
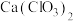 易溶于水。
易溶于水。①工业生产电石的反应为
 ,该反应中还原剂为
,该反应中还原剂为②流程中“制
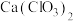 ”的化学方程式为
”的化学方程式为③上述流程中所用
 是用
是用 与浓盐酸反应制得。该反应的离子方程式是
与浓盐酸反应制得。该反应的离子方程式是 的是
的是
您最近一年使用:0次
2021-01-05更新
|
405次组卷
|
2卷引用:黑龙江省齐齐哈尔市2020-2021学年高一上学期期末考试化学试题
8 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
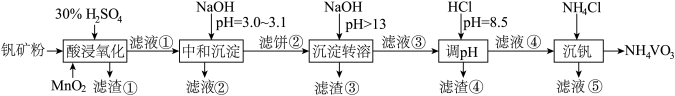
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________ 。
(2)“酸浸氧化”中,VO+和VO2+被氧化成 ,同时还有
,同时还有___________ 离子被氧化。写出VO+转化为 反应的离子方程式
反应的离子方程式___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、___________ ,以及部分的___________ 。
(4)“沉淀转溶”中,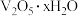 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是___________ 。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________ 。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”需要加热,其原因是
(2)“酸浸氧化”中,VO+和VO2+被氧化成
 ,同时还有
,同时还有 反应的离子方程式
反应的离子方程式(3)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、(4)“沉淀转溶”中,
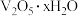 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是
您最近一年使用:0次
2020-07-08更新
|
23708次组卷
|
33卷引用:黑龙江省大庆铁人中学2022-2023学年高三上学期开学考试化学试题
黑龙江省大庆铁人中学2022-2023学年高三上学期开学考试化学试题2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题15 工艺流程题-2020年高考真题和模拟题化学分项汇编(已下线)第三单元 金属及其化合物测试题-2021年高考化学一轮复习名师精讲练河南省三门峡市第一高级中学2021届高三8月开学考试化学试题福建省福州市第一中学2021届高三上学期开学质检化学试题湖北省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)专题14 无机化工流程不丢分-2021年高考化学必做热点专题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)重点8 工艺流程综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 无机化工流程分析-2021年高考化学专练【热点·重点·难点】(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题(已下线)2021年高考全国乙卷化学试题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题四川省雅安中学2022-2023学年高二下学期3月月考化学试题(已下线)04 无机化工流程题(4) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)微专题 无机化工流程题的解题策略四川省成都市简阳实验学校2023-2024学年高三下学期开学考试理科综合试题-高中化学
9 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______ 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____ ,氧化性最弱的简单阳离子是____ 。
(2)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是_____ ;制铝时,电解Al2O3而不电解AlCl3的原因是_____ 。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)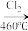 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)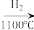 Si(纯)
Si(纯)
写出SiCl4的电子式:_____ ;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____ 。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为
(2)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)
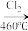 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)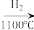 Si(纯)
Si(纯)写出SiCl4的电子式:
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:
您最近一年使用:0次
名校
10 . 按要求完成下列各问:
(1)将下列物质的颜色和用途或性质用短线连接起来。
①Fe2O3 a.红褐色 A.受热分解成红棕色粉末
②Fe(OH)2 b.红棕色 B.易被氧化成灰绿色最终变成红褐色
③Fe(OH)3 c.白色 C.红色油漆、涂料
④Fe2+ d.棕黄色 D.具有较强的还原性
⑤Fe3+ e.浅绿色 E.具有较强的氧化性
________ 、_____ 、_____ 、_____ 、_____
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处);
_____ KIO3+______ KI+______ H2SO4===______ K2SO4+______ I2+______ ( )
(1)将下列物质的颜色和用途或性质用短线连接起来。
①Fe2O3 a.红褐色 A.受热分解成红棕色粉末
②Fe(OH)2 b.红棕色 B.易被氧化成灰绿色最终变成红褐色
③Fe(OH)3 c.白色 C.红色油漆、涂料
④Fe2+ d.棕黄色 D.具有较强的还原性
⑤Fe3+ e.浅绿色 E.具有较强的氧化性
(2)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处);
您最近一年使用:0次



