名校
1 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 、___________ 。
(2) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(3)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与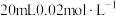 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(4)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(5)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为___________ 。

(2)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(3)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与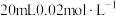 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(4)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(5)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为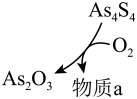
您最近一年使用:0次
2024-03-11更新
|
310次组卷
|
2卷引用:湖北省武汉市第二中学2023-2024学年高一下学期化学周练A卷(1)试卷
名校
解题方法
2 . 氧化性:Br2 > Fe3+> I2,向含 a mol FeI2和 a mol BaCl2的混合溶液中缓慢通入 b mol Br2,并不断搅拌,溶液中离子的物质的量随 Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化)。则下列说法不正确的是
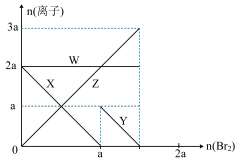

| A.离子的还原性 I-> Fe2+> Br- |
| B.四条线与溶液中离子的对应关系是: X-Fe2+、Y-I-、Z-Br-、W-Cl- |
| C.当4a =3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+):c(Br-) = 1:2:8 |
| D.当3a≤2b时,发生的离子方程式:2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br- |
您最近一年使用:0次
2020-04-21更新
|
307次组卷
|
2卷引用:湖北省武昌实验中学2023-2024学年高一上学期10月月考化学试题
名校
3 . 某化学兴趣小组利用如图装置,制备 并探究
并探究 的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
(2)请写出该实验中制备 的化学反应方程式
的化学反应方程式___________ 。
(3)湿润的 试纸的变化
试纸的变化___________ 。
(4)请写出 与
与 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式___________ 。
(5)拆装置前,需要进行的操作是___________ ,工业上通常使用氨水吸收 ,获得的产物有什么用途(列举一种即可)
,获得的产物有什么用途(列举一种即可)___________ 。
(6)实验完成后,该小组同学将实验室内空气样品经过管道通入密闭容器中的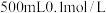 的酸性
的酸性 溶液中。已知
溶液中。已知 与该溶液反应的化学方程式为
与该溶液反应的化学方程式为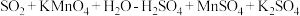 (未配平)若管道中空气流量为
(未配平)若管道中空气流量为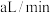 ,经过
,经过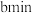 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可被溶液充分吸收。则空气样品中
可被溶液充分吸收。则空气样品中 的含量是
的含量是___________ 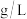 (用含
(用含 、
、 代数式表示)。
代数式表示)。
 并探究
并探究 的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
A. | B. | C. | D. |
(2)请写出该实验中制备
 的化学反应方程式
的化学反应方程式(3)湿润的
 试纸的变化
试纸的变化(4)请写出
 与
与 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式(5)拆装置前,需要进行的操作是
 ,获得的产物有什么用途(列举一种即可)
,获得的产物有什么用途(列举一种即可)(6)实验完成后,该小组同学将实验室内空气样品经过管道通入密闭容器中的
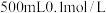 的酸性
的酸性 溶液中。已知
溶液中。已知 与该溶液反应的化学方程式为
与该溶液反应的化学方程式为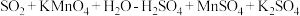 (未配平)若管道中空气流量为
(未配平)若管道中空气流量为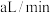 ,经过
,经过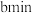 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可被溶液充分吸收。则空气样品中
可被溶液充分吸收。则空气样品中 的含量是
的含量是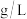 (用含
(用含 、
、 代数式表示)。
代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . 钼酸钠(Na2MoO4)具有广泛的用途,可作新型阻燃剂、水处理剂和无公害型冷却水系统的金属抑制剂等。回答下列问题:
Ⅰ.工业通过钼精矿(主要成分MoS2中硫为-2价)制备钼酸钠晶体的流程如图所示。____________________ 。
(2)写出粗产品焙烧的化学方程式____________________ 。
(3)实验室进行操作1所用的玻璃仪器是:烧杯、______ 、______ ,操作2的步骤是:______ 、______ 、过滤、洗涤、干燥。
(4)操作3中硫元素被氧化为最高价,发生反应的离子方程式为____________________ 。
Ⅱ.为实现绿色化学,也可从废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺流程如图: 的实验方法是
的实验方法是____________________ 。
(6)第③步操作中加入H2SO4需要适量,用离子方程式说明原因:____________________ (不考虑对 的影响)
的影响)
Ⅰ.工业通过钼精矿(主要成分MoS2中硫为-2价)制备钼酸钠晶体的流程如图所示。

(2)写出粗产品焙烧的化学方程式
(3)实验室进行操作1所用的玻璃仪器是:烧杯、
(4)操作3中硫元素被氧化为最高价,发生反应的离子方程式为
Ⅱ.为实现绿色化学,也可从废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺流程如图:

 的实验方法是
的实验方法是(6)第③步操作中加入H2SO4需要适量,用离子方程式说明原因:
 的影响)
的影响)
您最近一年使用:0次
2024-03-12更新
|
356次组卷
|
3卷引用:湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷
解题方法
5 . 三水合硝酸铜[Cu(NO3)2·3H2O,M=242g/mol]是一种重要的无机试剂,用途广泛。
回答下列问题:
Ⅰ.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。_______ 。
(2)由硝酸铜溶液获得三水合硝酸铜晶体过程中的一系列操作包括_______ 、过滤、洗涤、干燥。在洗涤操作中用乙醇洗涤的原因是_______ 。
(3)某工厂在用稀硝酸溶解废铜屑制备Cu(NO3)2·3H2O时,为避免NOx的生成,工程师提出还应加入H2O2溶液,反应的化学方程式为_______ ,当消耗含铜元素80%的废铜屑240kg时,得到653.4kg产品,产率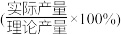 为
为_______ 。
Ⅱ.三水合硝酸铜[Cu(NO3)2·3H2O]的热分解实验。
(4)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为_______ ,继续升温至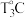 时生成的固体产物为
时生成的固体产物为_______ (填化学式)。
回答下列问题:
Ⅰ.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。
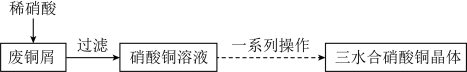
(2)由硝酸铜溶液获得三水合硝酸铜晶体过程中的一系列操作包括
(3)某工厂在用稀硝酸溶解废铜屑制备Cu(NO3)2·3H2O时,为避免NOx的生成,工程师提出还应加入H2O2溶液,反应的化学方程式为
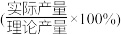 为
为Ⅱ.三水合硝酸铜[Cu(NO3)2·3H2O]的热分解实验。
(4)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在
 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为 时生成的固体产物为
时生成的固体产物为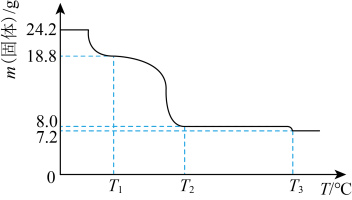
您最近一年使用:0次
名校
解题方法
6 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: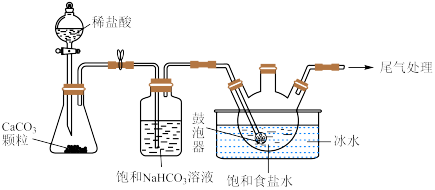
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
287次组卷
|
5卷引用:湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷
名校
7 . 氮及其化合物与生产生活及环境息息相关。请回答下列问题:
(1) 在常温下性质很稳定,任意写出一种与此性质有关的用途:
在常温下性质很稳定,任意写出一种与此性质有关的用途:_______ 。
(2)硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是_______ 。
A.酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
②在含有a g 的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有
的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有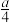 g
g  被还原,则
被还原,则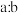 可能为
可能为_______ 。
A.2:1 B.3:1 C.4:1 D.9:2
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(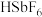 ),称为超强酸。氟锑酸可由
),称为超强酸。氟锑酸可由 与HF混合得到。
与HF混合得到。
①制备氟锑酸一般在塑料容器中进行,不在玻璃仪器中进行的原因是_______ (用化学方程式回答)
②1966年,美国研究员J·Lukas无意中将蜡烛扔进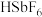 溶液中,发现蜡烛很快溶解,并放出
溶液中,发现蜡烛很快溶解,并放出 。已知碳正离子稳定性:
。已知碳正离子稳定性: ,写出等物质的量的异丁烷(
,写出等物质的量的异丁烷(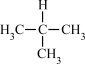 )与
)与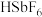 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
(1)
 在常温下性质很稳定,任意写出一种与此性质有关的用途:
在常温下性质很稳定,任意写出一种与此性质有关的用途:(2)硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是
A.酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
②在含有a g
 的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有
的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有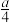 g
g  被还原,则
被还原,则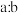 可能为
可能为A.2:1 B.3:1 C.4:1 D.9:2
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(
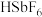 ),称为超强酸。氟锑酸可由
),称为超强酸。氟锑酸可由 与HF混合得到。
与HF混合得到。①制备氟锑酸一般在塑料容器中进行,不在玻璃仪器中进行的原因是
②1966年,美国研究员J·Lukas无意中将蜡烛扔进
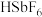 溶液中,发现蜡烛很快溶解,并放出
溶液中,发现蜡烛很快溶解,并放出 。已知碳正离子稳定性:
。已知碳正离子稳定性: ,写出等物质的量的异丁烷(
,写出等物质的量的异丁烷( )与
)与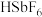 发生反应的化学方程式:
发生反应的化学方程式:
您最近一年使用:0次
解题方法
8 . 钒具有广泛用途。黏土钒矿中,钒以 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
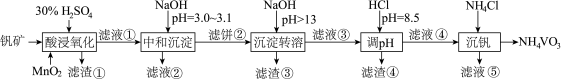
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)为了加快“酸浸氧化”的速率,可采取的措施有___________ (至少写两点)。
(2)“酸浸氧化”中, 和
和 被氧化成
被氧化成 ,同时还有
,同时还有___________ (写离子符号)被氧化,用离子方程式表示其来源:___________ 。写出 转化为
转化为 的离子方程式:
的离子方程式:___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、 以及部分的
以及部分的___________ 。
(4)“沉淀转溶”中, 转化为钒酸盐溶解,滤渣③的主要成分是
转化为钒酸盐溶解,滤渣③的主要成分是___________ 。
(5)“调pH”中有沉淀生成,生成沉淀反应的离子方程式是___________ 。如果“调pH”步骤中加入的盐酸过量可能导致___________ (结合钒的存在形式分析)。
 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
(1)为了加快“酸浸氧化”的速率,可采取的措施有
(2)“酸浸氧化”中,
 和
和 被氧化成
被氧化成 ,同时还有
,同时还有 转化为
转化为 的离子方程式:
的离子方程式:(3)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、 以及部分的
以及部分的(4)“沉淀转溶”中,
 转化为钒酸盐溶解,滤渣③的主要成分是
转化为钒酸盐溶解,滤渣③的主要成分是(5)“调pH”中有沉淀生成,生成沉淀反应的离子方程式是
您最近一年使用:0次
9 . 硫酸羟胺 为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺 为白色片状晶体,易溶于水、甲醇等,受热易分解。
为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)仪器a的作用为___________ ,三颈烧瓶中的试剂是___________
(2)装置A中反应的主要化学方程式为___________ 。
(3)开始实验时,应最先打开___________ (填“ ”“
”“ ”或“
”或“ ”)。
”)。
(4)流程中步骤Ⅰ的化学方程式是___________ 。
(5)分离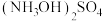 和
和 操作:①向二者混合溶液中加入氨水,生成
操作:①向二者混合溶液中加入氨水,生成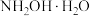 ,②再加入甲醇,加入甲醇的目的是
,②再加入甲醇,加入甲醇的目的是___________ ③过滤,将滤液进行___________ (填“常压”或“减压”)蒸馏,④接着加入硫酸,得到硫酸羟胺产品,写出发生反应的化学方程式___________
(6)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入 的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸
的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸 ,
, 气体全部逸出。将所得溶液冷却后,用
气体全部逸出。将所得溶液冷却后,用 酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=___________ mol。
 为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺
 为白色片状晶体,易溶于水、甲醇等,受热易分解。
为白色片状晶体,易溶于水、甲醇等,受热易分解。回答下列问题:
(1)仪器a的作用为
(2)装置A中反应的主要化学方程式为
(3)开始实验时,应最先打开
 ”“
”“ ”或“
”或“ ”)。
”)。(4)流程中步骤Ⅰ的化学方程式是
(5)分离
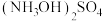 和
和 操作:①向二者混合溶液中加入氨水,生成
操作:①向二者混合溶液中加入氨水,生成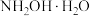 ,②再加入甲醇,加入甲醇的目的是
,②再加入甲醇,加入甲醇的目的是(6)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入
 的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸
的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸 ,
, 气体全部逸出。将所得溶液冷却后,用
气体全部逸出。将所得溶液冷却后,用 酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
您最近一年使用:0次
10 . 下列解释事实的离子方程式不正确的是
A.在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色:Cr2O +2OH-=2CrO +2OH-=2CrO +H2O +H2O |
B.牙齿表面薄层釉质[Ca5(PO4)3(OH)]易被有机酸溶解从而导致龋齿,含氟牙膏能起到预防龋齿的作用的原理:Ca5(PO4)3(OH)+F- Ca5(PO4)3F +OH- Ca5(PO4)3F +OH- |
C.泡沫灭火器的原理:2A13++3 +3H2O=2Al(OH)3↓+3CO2↑ +3H2O=2Al(OH)3↓+3CO2↑ |
D.TiO2化学性质非常稳定,在工业上有着广泛用途,可用TiCl4制备TiO2:TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl TiO2·xH2O↓+4HCl |
您最近一年使用:0次



