1 .  磁材料应用广泛,制备流程如图。下列说法错误的是
磁材料应用广泛,制备流程如图。下列说法错误的是
 磁材料应用广泛,制备流程如图。下列说法错误的是
磁材料应用广泛,制备流程如图。下列说法错误的是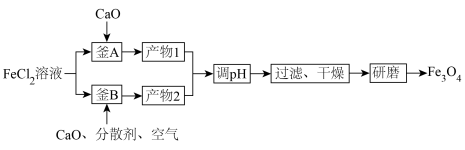
| A.“产物1”需要密封保存防止氧化 |
B.“釜B”中主要反应的化学方程式为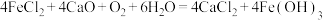 |
C.“产物1”与“产物2”中参与生成 反应的物质的物质的量之比为2:1 反应的物质的物质的量之比为2:1 |
| D.“分散剂”可破坏形成的胶体来促进氧化 |
您最近一年使用:0次
2 . 氧钒碱式碳酸铵晶体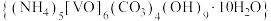 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。
Ⅰ.制备
步骤1:向 中加入足量盐酸酸化的
中加入足量盐酸酸化的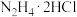 溶液,微沸数分钟。
溶液,微沸数分钟。
步骤2:向足量 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。
步骤3:反应结束后抽滤,先后用饱和 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。
(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为______ 。
(2)用无水乙醇洗涤的目的是______ 。
(3)“步骤2”可在如图装置中进行。______ 。(按气流方向,用字母标号表示)。
②检查装置气密性,加入试剂。先打开 ,通入一段时间气体目的是
,通入一段时间气体目的是______ ,当观察到______ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
③生成氧钒碱式碳酸铵晶体的化学方程式为______ 。
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用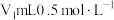 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗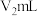 盐酸。
盐酸。
已知: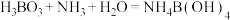 ,
, 。
。
(4)“冰盐水”的作用是______ 。
(5)样品中氮元素质量分数的表达式为______ 。
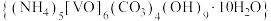 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。Ⅰ.制备
步骤1:向
 中加入足量盐酸酸化的
中加入足量盐酸酸化的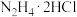 溶液,微沸数分钟。
溶液,微沸数分钟。步骤2:向足量
 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。步骤3:反应结束后抽滤,先后用饱和
 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为
(2)用无水乙醇洗涤的目的是
(3)“步骤2”可在如图装置中进行。
②检查装置气密性,加入试剂。先打开
 ,通入一段时间气体目的是
,通入一段时间气体目的是 ,打开
,打开 ,进行实验。
,进行实验。③生成氧钒碱式碳酸铵晶体的化学方程式为
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用
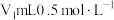 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗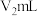 盐酸。
盐酸。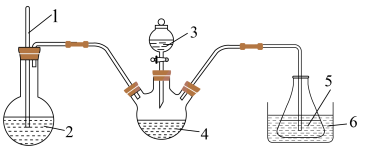
已知:
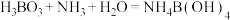 ,
, 。
。(4)“冰盐水”的作用是
(5)样品中氮元素质量分数的表达式为
您最近一年使用:0次
23-24高三上·山东德州·期末
解题方法
3 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和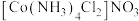 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,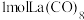 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和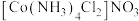 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是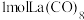 含
含 键。
键。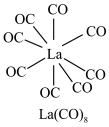
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)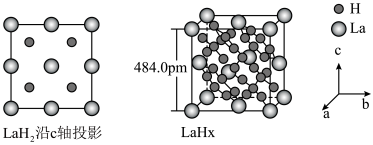
您最近一年使用:0次
4 . 采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
(1)钒基催化剂(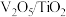 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: 的总反应化学方程式为
的总反应化学方程式为___________ ,该反应的中间体有___________ 种。
②若烟气中含有硫的氧化物,则会降低 的速率,可能的原因是
的速率,可能的原因是___________ 。
(2)研究发现:当烟气中 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: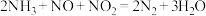 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: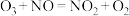 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得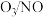 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。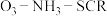 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是___________ (写两条)。
②温度低于250℃,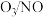 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是___________ 。
③实验发现,向烟气中先通入 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是___________
(3)以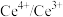 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示:___________ , 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
 )。
)。(1)钒基催化剂(
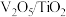 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: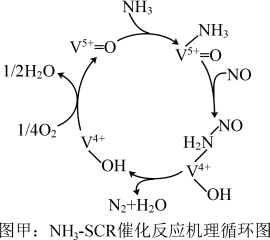
 的总反应化学方程式为
的总反应化学方程式为②若烟气中含有硫的氧化物,则会降低
 的速率,可能的原因是
的速率,可能的原因是(2)研究发现:当烟气中
 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: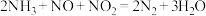 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: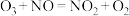 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得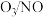 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。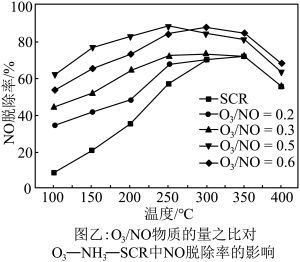
 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是②温度低于250℃,
 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是③实验发现,向烟气中先通入
 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是(3)以
 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示: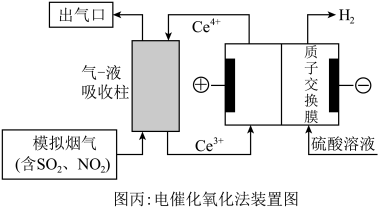
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
2024·海南省直辖县级单位·模拟预测
名校
解题方法
5 . 氧化钇( )广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、
)广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、 ,还含有一定量的
,还含有一定量的 、
、 、MgO)等)为原料生产
、MgO)等)为原料生产 的工艺流程如图所示:
的工艺流程如图所示: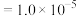 mol⋅L
mol⋅L 时,认为已沉淀完全。
时,认为已沉淀完全。
②常温下,相关金属离子开始沉淀和沉淀完全时的pH如图所示:
(1)“酸浸”时需适当提高浸取液的温度,其目的是_______ ;
采用离子浓度传感器测得相同时间内 的浸取率与浸取溶液温度的关系如图所示,
的浸取率与浸取溶液温度的关系如图所示, ℃后,
℃后, 的浸取率随温度升高而减小的原因是
的浸取率随温度升高而减小的原因是_______ 。_______ (填化学式)。
(3)“沉钇”后的滤液中浓度最大的金属离子是_______ (填离子符号);若常温下测得 恰好沉淀完全时滤液中
恰好沉淀完全时滤液中 mol⋅L
mol⋅L ,则
,则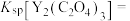
_______ mol⋅L (保留两位有效数字)。
(保留两位有效数字)。
(4)“沉钇”后所得晶体为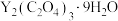 ,其中C元素的化合价为
,其中C元素的化合价为_______ 。
(5)“焙烧”时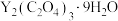 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
 )广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、
)广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、 ,还含有一定量的
,还含有一定量的 、
、 、MgO)等)为原料生产
、MgO)等)为原料生产 的工艺流程如图所示:
的工艺流程如图所示: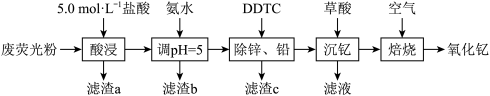
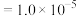 mol⋅L
mol⋅L 时,认为已沉淀完全。
时,认为已沉淀完全。②常温下,相关金属离子开始沉淀和沉淀完全时的pH如图所示:

(1)“酸浸”时需适当提高浸取液的温度,其目的是
采用离子浓度传感器测得相同时间内
 的浸取率与浸取溶液温度的关系如图所示,
的浸取率与浸取溶液温度的关系如图所示, ℃后,
℃后, 的浸取率随温度升高而减小的原因是
的浸取率随温度升高而减小的原因是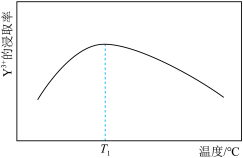
(3)“沉钇”后的滤液中浓度最大的金属离子是
 恰好沉淀完全时滤液中
恰好沉淀完全时滤液中 mol⋅L
mol⋅L ,则
,则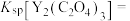
 (保留两位有效数字)。
(保留两位有效数字)。(4)“沉钇”后所得晶体为
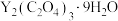 ,其中C元素的化合价为
,其中C元素的化合价为(5)“焙烧”时
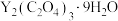 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
2024-05-07更新
|
126次组卷
|
3卷引用:T18-工业流程题
名校
6 . 二氧化氯( )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是
 )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是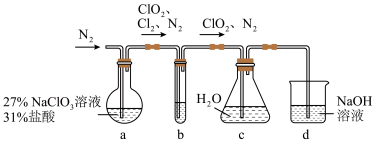
A.装置a的反应产物中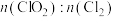 的比值一定为2:1 的比值一定为2:1 |
| B.装置b的主要作用是除去混合气体中的HCl |
C.通入氮气的目的为稀释装置a中产生的 并使其中产生的气体全部进入后续装置 并使其中产生的气体全部进入后续装置 |
D.装置d可除去多余的 |
您最近一年使用:0次
23-24高三上·山东德州·期末
解题方法
7 . 锂离子电池正极材料(主要成分为 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: ,
, ,
, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入 溶液中,其目的是
溶液中,其目的是________ 。
(2)滤液1的主要成分是________ (填化学式,下同)。滤液2的主要成分是________ 。
(3)“酸溶”时发生的主要反应的离子方程式________ ;不用盐酸替代硫酸的原因是________ 。
(4)不宜使用 沉钴的原因是
沉钴的原因是________ 。
(5) ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
________ 。
(6)若最终得到产品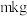 ,则可以重新制备
,则可以重新制备________  正极材料(含钴
正极材料(含钴 )。
)。
 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: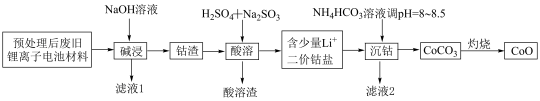
 ,
, ,
, 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入
 溶液中,其目的是
溶液中,其目的是(2)滤液1的主要成分是
(3)“酸溶”时发生的主要反应的离子方程式
(4)不宜使用
 沉钴的原因是
沉钴的原因是(5)
 ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
(6)若最终得到产品
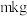 ,则可以重新制备
,则可以重新制备 正极材料(含钴
正极材料(含钴 )。
)。
您最近一年使用:0次
2024·甘肃平凉·模拟预测
8 . 环己酮是无色油状液体, 时在水中的溶解度为
时在水中的溶解度为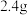 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。
【实验原理】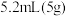 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
Ⅱ.在室温下继续搅拌 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。
Ⅲ.在反应混合物中加入 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。
回答下列问题。
(1)仪器X的名称为_______ 。
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是_______ 。用淀粉碘化钾试纸可检验反应后的液体,如果试纸变_______ 色,说明次氯酸钠过量。
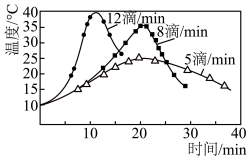
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为_______ 滴/ 。
。_______ 。
(5)在步骤Ⅳ中,加入精制食盐的目的是_______ 。
(6)在步骤Ⅴ中,加入无水 的作用为
的作用为_______ 。
(7)产品的产率为_______ (精确至0.1%)。
 时在水中的溶解度为
时在水中的溶解度为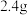 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。【实验原理】
 +NaClO
+NaClO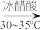
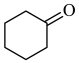 +NaCl+H2O
+NaCl+H2O 
【装置示意图】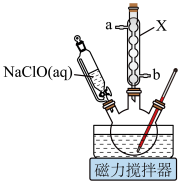
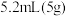 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。Ⅱ.在室温下继续搅拌
 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。Ⅲ.在反应混合物中加入
 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水
 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。回答下列问题。
(1)仪器X的名称为
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为
 。
。
(5)在步骤Ⅳ中,加入精制食盐的目的是
(6)在步骤Ⅴ中,加入无水
 的作用为
的作用为(7)产品的产率为
您最近一年使用:0次
23-24高三下·河北沧州·阶段练习
名校
解题方法
9 . 镍-镉电池是一种非常理想的直流供电电池。废旧镍-镉电池中含有镍、镉、铁及少量钴和有机质等。回收利用废旧镍-镉电池的一种工艺流程如图所示。
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是_____ 。
(2)“氧化”工序发生主要反应的离子方程式为_____ 。
(3)试剂X可选择_____(填标号)。
(4)已知: 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中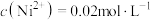 ,则应控制pH小于
,则应控制pH小于_____ 。
(5)滤渣2可表示为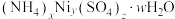 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为_____ 。
(6)滤液1经处理之后可循环至_____ 工序中使用。
(7) 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的_____ (填“阳极”或“阴极”)产生纯镉。
(8)一项研究表明,采用溶剂萃取法可将 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为_____ 。
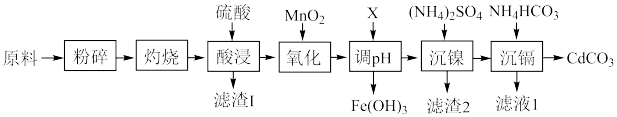
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是
(2)“氧化”工序发生主要反应的离子方程式为
(3)试剂X可选择_____(填标号)。
| A.氨水 | B.NaOH溶液 | C.NiO | D. 溶液 溶液 |
(4)已知:
 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中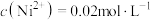 ,则应控制pH小于
,则应控制pH小于(5)滤渣2可表示为
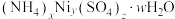 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为(6)滤液1经处理之后可循环至
(7)
 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的(8)一项研究表明,采用溶剂萃取法可将
 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为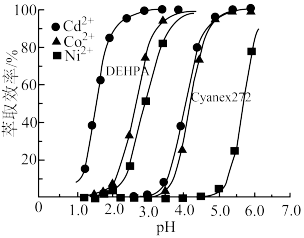
您最近一年使用:0次
2024-04-24更新
|
375次组卷
|
6卷引用:T18-工业流程题
解题方法
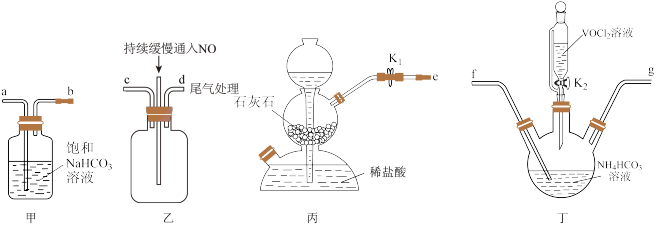
10 . 硝酸铈(Ⅳ)铵的化学式为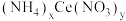 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。___________ ,装置C的作用是___________ 。该实验以氮化钙和水制备NH3应选择装置___________ (填“A”或“D”)。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为___________ 。装置B中发生反应的离子方程式为___________ 。
(3)该实验装置存在的一处缺陷为___________ 。
步骤二:制备硝酸铈(Ⅳ)铵___________ 。
(5)“烘干”采取自然干燥的原因为___________ 。
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用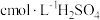 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
(6)计算y=___________ (用上述字母表示)。
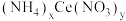 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。
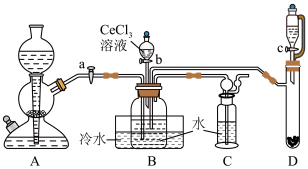
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:制备硝酸铈(Ⅳ)铵

(5)“烘干”采取自然干燥的原因为
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用
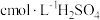 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。(6)计算y=
您最近一年使用:0次
2024-02-02更新
|
256次组卷
|
3卷引用:山东省青岛市黄岛区2023-2024学年高三上学期期末考试化学试题



