解题方法
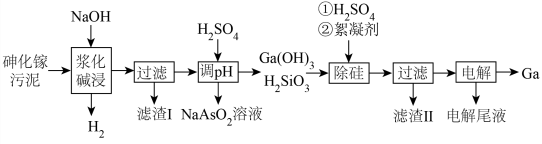
1 . 镓( )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
已知:Ⅰ.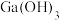 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;
Ⅱ. 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。
回答下列问题:
(1)“浆化碱浸”过程中 反应的离子方程式为
反应的离子方程式为________ ;“滤渣Ⅰ”的成分为______ (填化学式)。
(2)中和“调 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是_______ 。
(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的 调节至
调节至______ 范围内,沉淀效果最好;此过程中,加入絮凝剂的目的是_______ 。
(4) 溶液经
溶液经_________ 、______ 、抽滤、洗涤、干燥得 晶体。
晶体。
(5)用惰性电极电解得到电解尾液和 ,电解尾液可在
,电解尾液可在______ (填操作单元名称)过程中循环使用,提高经济效益。
(6) 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
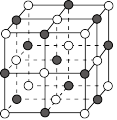
① 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为_____ 。
②距离最近的两个 原子之间的距离为
原子之间的距离为_______  (用含
(用含 的代数式表示)。
的代数式表示)。
 )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
已知:Ⅰ.
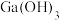 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;Ⅱ.
 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。回答下列问题:
(1)“浆化碱浸”过程中
 反应的离子方程式为
反应的离子方程式为(2)中和“调
 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的
 调节至
调节至 |  |  |
| 0.0 | 2500 | 1345 |
| 0.5 | 2456 | 1267 |
| 1.0 | 2438 | 81 |
| 1.5 | 2420 | 103 |
| 2.0 | 2200 | 804 |
| 2.5 | 1879 | 952 |
(4)
 溶液经
溶液经 晶体。
晶体。(5)用惰性电极电解得到电解尾液和
 ,电解尾液可在
,电解尾液可在(6)
 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
①
 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为②距离最近的两个
 原子之间的距离为
原子之间的距离为 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 食盐中加 可预防碘缺乏症。某研究小组制取
可预防碘缺乏症。某研究小组制取 并对其纯度进行测定。
并对其纯度进行测定。
Ⅰ.制取 样品
样品
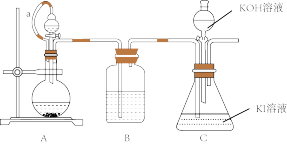
①原理: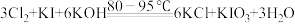
②装置:(C的加热装置已省略)
Ⅱ.分离提纯
①取C中溶液,加入浓盐酸,搅拌冷却,过滤,洗涤,得到 粗产品。
粗产品。
②将 粗产品溶于水,加入KOH调pH至中性,得
粗产品溶于水,加入KOH调pH至中性,得 产品。
产品。
回答下列问题:
(1)用装置A制取氯气,可选择的氧化剂有___________。
(2)橡胶管a的作用是___________ ;该装置的设计缺陷是___________ 。
(3)配制一定浓度KI溶液,下列仪器一定不需要的是___________ (填仪器名称)。

(4)装置C中溶液有KI剩余,加入浓盐酸会导致 产率偏小,原因是
产率偏小,原因是___________ (用离子方程式表示)。
III.测定 产品纯度
产品纯度
a.取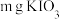 产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用
产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用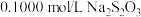 标准液滴定至终点,测得消耗标准液的平均体积为VmL。
标准液滴定至终点,测得消耗标准液的平均体积为VmL。
b.不加 产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗
产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗 标准液的平均体积为
标准液的平均体积为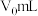 。(已知:
。(已知: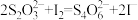 )
)
(5)步骤a中滴定终点的现象是___________ 。
(6)计算该 样品的纯度:
样品的纯度:___________ (填数学表达式)。
 可预防碘缺乏症。某研究小组制取
可预防碘缺乏症。某研究小组制取 并对其纯度进行测定。
并对其纯度进行测定。Ⅰ.制取
 样品
样品
①原理:
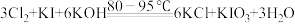
②装置:(C的加热装置已省略)
Ⅱ.分离提纯
①取C中溶液,加入浓盐酸,搅拌冷却,过滤,洗涤,得到
 粗产品。
粗产品。②将
 粗产品溶于水,加入KOH调pH至中性,得
粗产品溶于水,加入KOH调pH至中性,得 产品。
产品。回答下列问题:
(1)用装置A制取氯气,可选择的氧化剂有___________。
| A.高锰酸钾 | B.二氧化锰 | C.氯酸钾 | D.氯化钾 |
(3)配制一定浓度KI溶液,下列仪器一定不需要的是

(4)装置C中溶液有KI剩余,加入浓盐酸会导致
 产率偏小,原因是
产率偏小,原因是III.测定
 产品纯度
产品纯度a.取
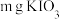 产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用
产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用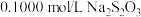 标准液滴定至终点,测得消耗标准液的平均体积为VmL。
标准液滴定至终点,测得消耗标准液的平均体积为VmL。b.不加
 产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗
产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗 标准液的平均体积为
标准液的平均体积为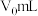 。(已知:
。(已知: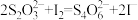 )
)(5)步骤a中滴定终点的现象是
(6)计算该
 样品的纯度:
样品的纯度:
您最近一年使用:0次
名校
解题方法
3 . 铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为 、
、 ,还有少量
,还有少量 、
、 、
、 )制备
)制备 的流程如图:
的流程如图:

回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是___________ 。
(2)向废铅膏粉中加入 溶液可将
溶液可将 转化为
转化为 ,并除去
,并除去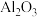 ,写出除去
,写出除去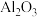 的反应的离子方程式
的反应的离子方程式___________ 。
(3)溶液I中主要含有的阴离子有 、
、___________ 。
(4)加入 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为 。
。 转化为
转化为 的化学方程式是
的化学方程式是___________ 。
(5)为使 完全沉淀并获得纯净的
完全沉淀并获得纯净的 ,需向溶液Ⅱ中分两次加入
,需向溶液Ⅱ中分两次加入 溶液。第一次加入的目的是
溶液。第一次加入的目的是___________ ,过滤后,第二次加入 溶液调节溶液的
溶液调节溶液的 至少为
至少为___________ 。(已知:25℃, ,
, ,离子浓度
,离子浓度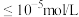 可视为沉淀完全)
可视为沉淀完全)
 、
、 ,还有少量
,还有少量 、
、 、
、 )制备
)制备 的流程如图:
的流程如图:
回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是
(2)向废铅膏粉中加入
 溶液可将
溶液可将 转化为
转化为 ,并除去
,并除去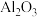 ,写出除去
,写出除去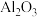 的反应的离子方程式
的反应的离子方程式(3)溶液I中主要含有的阴离子有
 、
、(4)加入
 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为 。
。 转化为
转化为 的化学方程式是
的化学方程式是(5)为使
 完全沉淀并获得纯净的
完全沉淀并获得纯净的 ,需向溶液Ⅱ中分两次加入
,需向溶液Ⅱ中分两次加入 溶液。第一次加入的目的是
溶液。第一次加入的目的是 溶液调节溶液的
溶液调节溶液的 至少为
至少为 ,
, ,离子浓度
,离子浓度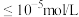 可视为沉淀完全)
可视为沉淀完全)
您最近一年使用:0次
2022-08-15更新
|
772次组卷
|
3卷引用:广东省梅州市大埔县虎山中学2022-2023学年高三上学期11月月考化学试题
广东省梅州市大埔县虎山中学2022-2023学年高三上学期11月月考化学试题广东省广州市省实、执信、广雅、六中四校2022-2023学年高三8月联考化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
4 . 铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为___ 。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为___ 。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如图:
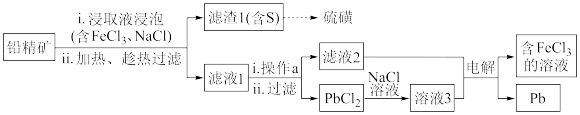
已知:①不同温度下PbCl2的溶解度如下表所示。
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq) PbCl42-(aq)。
PbCl42-(aq)。
(3)铅精矿浸取后“趁热过滤”的原因是___ 。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出。试分析“加适量水稀释”可能的原因是___ 。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于___ (填“阴极室”或“阳极室”)中。
②滤液2电解后可实现FeCl3的再生,该电极的电极反应式___ 。
③若铅精矿的质量为ag,铅浸出率为b,当电解池中通过cmol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___ (用a、b、c的代数式表示)。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如图:
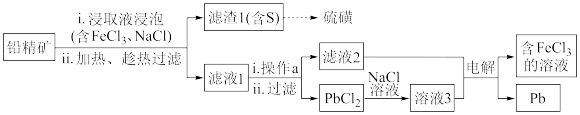
已知:①不同温度下PbCl2的溶解度如下表所示。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)
 PbCl42-(aq)。
PbCl42-(aq)。(3)铅精矿浸取后“趁热过滤”的原因是
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出。试分析“加适量水稀释”可能的原因是
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于
②滤液2电解后可实现FeCl3的再生,该电极的电极反应式
③若铅精矿的质量为ag,铅浸出率为b,当电解池中通过cmol电子时,金属铅全部析出,铅精矿中PbS的质量分数为
您最近一年使用:0次



