名校
解题方法
1 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4,含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
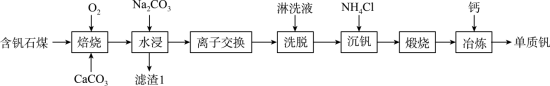
已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
②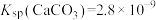 ,
,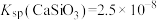 ,
,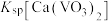 远大于
远大于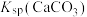 。
。
回答下列问题:
(1)基态Fe3+的价电子排布式为___________ 。
(2)为了提高“焙烧”效率,可采取的措施有___________ 、___________ 。
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)3,写出V2O4转化为Ca(VO3)3的化学方程式:___________ 。
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有___________ ;“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3,原因是___________ 。(列式计算平衡常数分析该反应进行的趋势,一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)
(5)“离子交换”与“洗脱”可表示为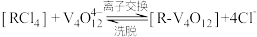 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,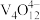 为VO
为VO 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用___________ 。
(6)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是___________ 。
(7)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。

已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
| 金属离子 | Fe3+ | Mg2+ | Al3+ | Mn2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
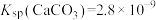 ,
,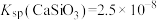 ,
,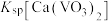 远大于
远大于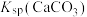 。
。回答下列问题:
(1)基态Fe3+的价电子排布式为
(2)为了提高“焙烧”效率,可采取的措施有
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)3,写出V2O4转化为Ca(VO3)3的化学方程式:
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有
(5)“离子交换”与“洗脱”可表示为
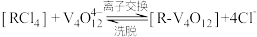 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,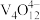 为VO
为VO 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(6)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是
(7)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
解题方法
2 . 某兴趣小组在实验室模拟海带提取碘的实验,并探究氧化剂及其作用原理。
Ⅰ.模拟海带提碘实验
该小组同学按如下实验流程进行实验:

(1)“步骤①”中发生反应生成碘单质,其离子方程式为_______ 。
(2)“步骤②”的操作名称是_______ 、_______ 。
Ⅱ.探究可用于海带提碘的氧化剂
ⅰ.实验准备
(3)配制 溶液
溶液
①需要称量 固体的质量是
固体的质量是_______  (保留2位小数)。
(保留2位小数)。
②在实验室配制上述溶液的过程中,需使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______ (填仪器名称)。
ⅱ.选用 作氧化剂
作氧化剂
(4)向试管中加入 溶液,再加入
溶液,再加入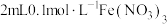 溶液(
溶液(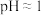 ),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
假设1: 作氧化剂;
作氧化剂;
假设2:酸性条件下 作氧化剂;
作氧化剂;
假设3: 和酸性条件下的
和酸性条件下的 都作氧化剂。
都作氧化剂。
限选试剂: 溶液、
溶液、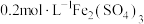 溶液、
溶液、 溶液、
溶液、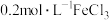 溶液
溶液
ⅲ.选用 作氧化剂
作氧化剂
(5)向试管中加入 溶液,再加入
溶液,再加入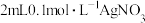 溶液
溶液 ,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为
,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为_______ (填化学式);静置后取上层清液,向其中滴加2滴淀粉溶液,溶液未变篮,说明 未氧化
未氧化 。
。
(6)资料显示,同浓度的 的氧化能力强于
的氧化能力强于 的。为进一步探究
的。为进一步探究 能否氧化
能否氧化 ,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。

①上述装置的盐桥中应选择_______ 作为电解质(填标号)。
A. B.
B. C.
C. D.
D.
②与(5)中实验相比,(6)中装置能够实现 氧化
氧化 的原因是
的原因是_______ 。
Ⅰ.模拟海带提碘实验
该小组同学按如下实验流程进行实验:

(1)“步骤①”中发生反应生成碘单质,其离子方程式为
(2)“步骤②”的操作名称是
Ⅱ.探究可用于海带提碘的氧化剂
ⅰ.实验准备
(3)配制
 溶液
溶液①需要称量
 固体的质量是
固体的质量是 (保留2位小数)。
(保留2位小数)。②在实验室配制上述溶液的过程中,需使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、
ⅱ.选用
 作氧化剂
作氧化剂(4)向试管中加入
 溶液,再加入
溶液,再加入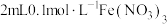 溶液(
溶液(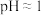 ),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。
),充分混合,溶液呈棕黄色;再向上述溶液中滴加2滴淀粉溶液,溶液变蓝。针对上述实验现象,该小组同学提出以下假设并进行相关实验探究。假设1:
 作氧化剂;
作氧化剂;假设2:酸性条件下
 作氧化剂;
作氧化剂;假设3:
 和酸性条件下的
和酸性条件下的 都作氧化剂。
都作氧化剂。限选试剂:
 溶液、
溶液、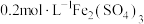 溶液、
溶液、 溶液、
溶液、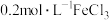 溶液
溶液| 实验操作 | 实验现象 | 实验结论 |
向试管中加入 溶液,再加入 溶液,再加入 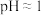 ),充分混合,再滴加2滴淀粉溶液 ),充分混合,再滴加2滴淀粉溶液 | 溶海变蓝 | 假设3成立 |
向试管中加入 溶液,再加入 溶液,再加入 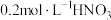 溶液和 溶液和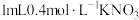 溶液,充分反应后,再滴加2滴淀粉溶液 溶液,充分反应后,再滴加2滴淀粉溶液 |
ⅲ.选用
 作氧化剂
作氧化剂(5)向试管中加入
 溶液,再加入
溶液,再加入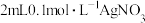 溶液
溶液 ,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为
,充分混合,试管中出现黄色沉淀,该黄色沉淀的主要成分为 未氧化
未氧化 。
。(6)资料显示,同浓度的
 的氧化能力强于
的氧化能力强于 的。为进一步探究
的。为进一步探究 能否氧化
能否氧化 ,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
,该小组设计如图所示装置进行实验。实验过程中,观察到电流表指针发生偏转。
①上述装置的盐桥中应选择
A.
 B.
B. C.
C. D.
D.
②与(5)中实验相比,(6)中装置能够实现
 氧化
氧化 的原因是
的原因是
您最近一年使用:0次
3 . 废旧锂离子电池的正极材料主要成分是LiCoO2,还含有少量金属Al、Fe以及其他不溶性物质,采用如下工艺流程回收其中的钴制备Co单质:

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“滤液1”中主要存在的阴离子有_______ 。
(2)“酸浸”中LiCoO2发生反应的化学方程式为_______ 。“酸浸”时需要控制温度在80~85℃,温度不宜过高的原因是_______ 。
(3)“滤渣2”的主要成分是Fe(OH)3,如果“酸浸”后的溶液中Co2+浓度为1.0mol·L−1,则“调pH1”应控制的pH范围是_______ 。
(4)“酸溶”中发生反应的离子方程式为_______ 。
(5)“电解”制备Co的装置如图所示,阴极电极反应式为_______ ,电解后a室中的电解质溶液可以返回_______ 工序循环使用。


溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Co2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L−1)的pH | 7.8 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10−5mol·L−1)的pH | 9.3 | 4.7 | 3.2 | 9.0 |
(1)“滤液1”中主要存在的阴离子有
(2)“酸浸”中LiCoO2发生反应的化学方程式为
(3)“滤渣2”的主要成分是Fe(OH)3,如果“酸浸”后的溶液中Co2+浓度为1.0mol·L−1,则“调pH1”应控制的pH范围是
(4)“酸溶”中发生反应的离子方程式为
(5)“电解”制备Co的装置如图所示,阴极电极反应式为

您最近一年使用:0次
名校
4 . 钾离子电池以其优异的性能成为替代理离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含 、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:

已知:I.放电时负极的电极反应式为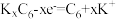 ;
;
II.常温下, ,当溶液中某离子浓度低于
,当溶液中某离子浓度低于 时,认为该离子已沉淀完全。
时,认为该离子已沉淀完全。
回答下列问题:
(1)废旧电池放电处理的原因为___________ 。
(2)“碱浸”时发生的化学反应方程式为___________ 。
(3)已知 中的铁为+3价,则“酸溶”时主要反应的离子方程式为
中的铁为+3价,则“酸溶”时主要反应的离子方程式为___________ ;该工序中温度需控制在40℃的原因为___________ 。
(4)若最终调节pH=3,则所得母液中的
___________ (填“已”或“未”)沉淀完全。
(5)实验室中从“反萃取”所得混合液中分离出 溶液的操作名称为
溶液的操作名称为___________ 。
(6)废旧钾离子电池放电处理并拆解后,从负极得到石墨,其结构如图。石墨两层之间最近碳原子间距远大于层内最近碳原子间距的原因为___________ ;设阿伏加德罗常数的值为 ,则石墨晶体密度为
,则石墨晶体密度为___________  (列式即可)。
(列式即可)。

 、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
已知:I.放电时负极的电极反应式为
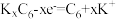 ;
;II.常温下,
 ,当溶液中某离子浓度低于
,当溶液中某离子浓度低于 时,认为该离子已沉淀完全。
时,认为该离子已沉淀完全。回答下列问题:
(1)废旧电池放电处理的原因为
(2)“碱浸”时发生的化学反应方程式为
(3)已知
 中的铁为+3价,则“酸溶”时主要反应的离子方程式为
中的铁为+3价,则“酸溶”时主要反应的离子方程式为(4)若最终调节pH=3,则所得母液中的

(5)实验室中从“反萃取”所得混合液中分离出
 溶液的操作名称为
溶液的操作名称为(6)废旧钾离子电池放电处理并拆解后,从负极得到石墨,其结构如图。石墨两层之间最近碳原子间距远大于层内最近碳原子间距的原因为
 ,则石墨晶体密度为
,则石墨晶体密度为 (列式即可)。
(列式即可)。
您最近一年使用:0次
2022-08-28更新
|
746次组卷
|
2卷引用:广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
名校
解题方法
5 . 下图是以太阳能为能源分解水制H2过程示意图。下列说法中,错误的是
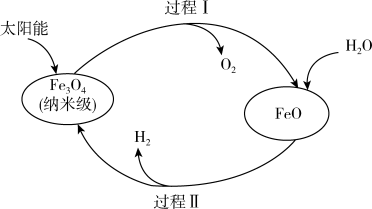

A.过程Ⅰ的反应: |
B.过程Ⅱ的反应: |
| C.两个转化过程都发生了氧化还原反应 |
D.纳米级 在整个过程中起催化作用 在整个过程中起催化作用 |
您最近一年使用:0次
2022-01-25更新
|
291次组卷
|
21卷引用:广东省深圳市第七高级中学2020-2021学年高一上学期第一学段考试化学试题
广东省深圳市第七高级中学2020-2021学年高一上学期第一学段考试化学试题广东省深圳市观澜中学2021-2022学年高一上学期12月月考质量检测化学试题广东省深圳市光明区高级中学2022-2023学年高一 上学期月考化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高一10月月考化学试题湖北省随州市第一中学2020-2021学年高一9月月考化学试题黑龙江省哈尔滨师范大学附属中学2020—2021学年高一上学期第一次月考化学试题(已下线)第10单元 化学反应速率与化学平衡(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷陕西省宝鸡市金台区2020-2021学年高一上学期期中考试化学试题1四川省成都外国语学校2020-2021学年高一上学期期中考试化学试题陕西省宝鸡市金台区2020-2021学年高一上学期期中考试化学试题2广东省中山市迪茵公学2020-2021学年高一上学期10月月考化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00137】(已下线)【苏州新东方】08 苏高黑龙江省鸡西实验中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市第二中学2021-2022学年高一上学期10月月考化学试题广东省广州市三校2021-2022学年高一上学期期中联考化学试题青海省西宁市2021-2022学年高一上学期期末考试化学试题广东省珠海市实验中学与河源高级中学2021-2022学年高一上学期12月考试化学试题安徽省马鞍山市第二中学2022-2023学年高一上学期期中考试化学试题广东省韶关市武江区北江实验中学2022-2023学年高一上学期第一次月考化学试题江西省南昌第二中学2023-2024学年高一上学期第一次月考化学试题
名校
解题方法
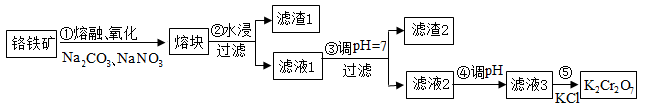
6 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备。铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为
Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为____________ 。该步骤不能使用陶瓷容器,原因是________ (用化学方程式表示)。
(2)滤渣1中含量最多的金属元素是____ (填写元素符号),设计实验方案验证滤渣1中经步骤①中反应后的产物_____ 。滤渣2的主要成分是______ (填写化学式)及含硅杂质。
(3)步骤④调滤液2的pH使之变________ (填“大”或“小”),原因是_________ (用离子方程式和适当的文字表述说明)。
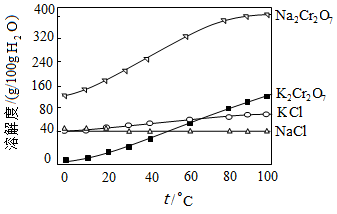
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式____________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为
Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式

您最近一年使用:0次
2020-11-19更新
|
226次组卷
|
2卷引用:广东省深圳外国语学校2021届高三第二次月考化学试题



