名校
解题方法
1 . 下列离子反应方程式正确的是
A.氯气通入冷的石灰乳: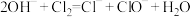 |
B.向NaHCO3溶液中滴入少量澄清石灰水: |
C.向明矾溶液中滴加Ba(OH)2溶液到 恰好完全沉淀时: 恰好完全沉淀时: |
| D.向FeI2溶液中通入少量氯气:Cl2 + 2I- = 2Cl- + I2 |
您最近一年使用:0次
名校
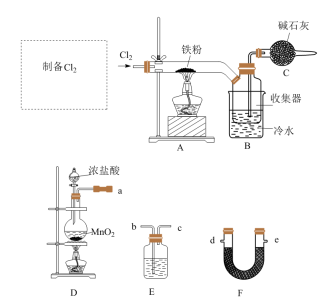
2 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
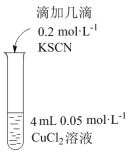
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: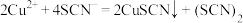 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向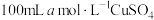 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量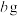 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
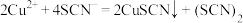 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
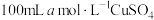 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量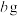 ,则
,则 的产率为
的产率为
您最近一年使用:0次
2023-03-10更新
|
1014次组卷
|
3卷引用:广东省广州大学附属中学2023-2024学年高三上学期开学考试化学试题
解题方法
3 . 铋(Bi)因无毒与不致癌性而有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为 ,含杂质
,含杂质 等)制备
等)制备 的工艺如下:
的工艺如下:

回答下列问题:
(1)铋元素位于元素周期表第六周期ⅤA族,用轨道表示式表示基态铋原子最外层结构___________ ,铋的氢化物的热稳定性___________ (填“大于”或“小于”)氨。
(2)“浸出”前,辉铋矿会先进行粉碎,目的是___________ 。
(3)已知“浸出液”中含有 离子,则“浸出”时
离子,则“浸出”时 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ 。
(4)“精炼”时,粗铋应作___________ 材料(填“阴极”或“阳极”)。
(5)碱式硝酸铋直接灼烧也能得到 ,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是
,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是___________ ;“母液2”中可回收的主要物质是___________ (填写物质的化学式)。
 ,含杂质
,含杂质 等)制备
等)制备 的工艺如下:
的工艺如下:
回答下列问题:
(1)铋元素位于元素周期表第六周期ⅤA族,用轨道表示式表示基态铋原子最外层结构
(2)“浸出”前,辉铋矿会先进行粉碎,目的是
(3)已知“浸出液”中含有
 离子,则“浸出”时
离子,则“浸出”时 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为(4)“精炼”时,粗铋应作
(5)碱式硝酸铋直接灼烧也能得到
 ,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是
,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是
您最近一年使用:0次
22-23高三上·山东烟台·期末
4 . 工业上以铬矿渣(主要成分为 ,含有少量的
,含有少量的 )制备重要化工原料重铬酸钾
)制备重要化工原料重铬酸钾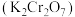 晶体的工艺流程如下:
晶体的工艺流程如下:
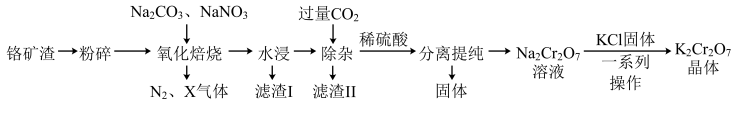
已知:①焙烧可将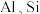 的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
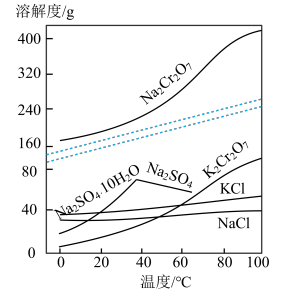
回答下列问题:
(1)“氧化焙烧”时, 被氧化生成
被氧化生成 的化学方程式为
的化学方程式为_______ 。
(2)“滤渣I”、“滤渣II”的主要成分分别是_______ 、_______ (填化学式):实验室中进行“除杂”操作用到的玻璃仪器有_______ 。
(3)分离提纯后得到固体的化学式为_______ ;“一系列操作”是_______ 、过滤、洗涤、干燥,最后得到 晶体。
晶体。
(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到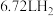 (标准状况下)时有
(标准状况下)时有_______ molCr2O 被还原,一段时间后产生
被还原,一段时间后产生 和
和 沉淀,若电解后溶液中
沉淀,若电解后溶液中 ,则
,则
_______  。(已知
。(已知 )
)

 ,含有少量的
,含有少量的 )制备重要化工原料重铬酸钾
)制备重要化工原料重铬酸钾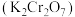 晶体的工艺流程如下:
晶体的工艺流程如下:
已知:①焙烧可将
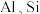 的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
回答下列问题:
(1)“氧化焙烧”时,
 被氧化生成
被氧化生成 的化学方程式为
的化学方程式为(2)“滤渣I”、“滤渣II”的主要成分分别是
(3)分离提纯后得到固体的化学式为
 晶体。
晶体。(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到
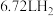 (标准状况下)时有
(标准状况下)时有 被还原,一段时间后产生
被还原,一段时间后产生 和
和 沉淀,若电解后溶液中
沉淀,若电解后溶液中 ,则
,则
 。(已知
。(已知 )
)
您最近一年使用:0次
名校
解题方法
5 . 铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为 、
、 ,还有少量
,还有少量 、
、 、
、 )制备
)制备 的流程如图:
的流程如图:

回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是___________ 。
(2)向废铅膏粉中加入 溶液可将
溶液可将 转化为
转化为 ,并除去
,并除去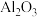 ,写出除去
,写出除去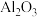 的反应的离子方程式
的反应的离子方程式___________ 。
(3)溶液I中主要含有的阴离子有 、
、___________ 。
(4)加入 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为 。
。 转化为
转化为 的化学方程式是
的化学方程式是___________ 。
(5)为使 完全沉淀并获得纯净的
完全沉淀并获得纯净的 ,需向溶液Ⅱ中分两次加入
,需向溶液Ⅱ中分两次加入 溶液。第一次加入的目的是
溶液。第一次加入的目的是___________ ,过滤后,第二次加入 溶液调节溶液的
溶液调节溶液的 至少为
至少为___________ 。(已知:25℃, ,
, ,离子浓度
,离子浓度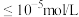 可视为沉淀完全)
可视为沉淀完全)
 、
、 ,还有少量
,还有少量 、
、 、
、 )制备
)制备 的流程如图:
的流程如图:
回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是
(2)向废铅膏粉中加入
 溶液可将
溶液可将 转化为
转化为 ,并除去
,并除去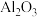 ,写出除去
,写出除去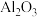 的反应的离子方程式
的反应的离子方程式(3)溶液I中主要含有的阴离子有
 、
、(4)加入
 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为 。
。 转化为
转化为 的化学方程式是
的化学方程式是(5)为使
 完全沉淀并获得纯净的
完全沉淀并获得纯净的 ,需向溶液Ⅱ中分两次加入
,需向溶液Ⅱ中分两次加入 溶液。第一次加入的目的是
溶液。第一次加入的目的是 溶液调节溶液的
溶液调节溶液的 至少为
至少为 ,
, ,离子浓度
,离子浓度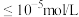 可视为沉淀完全)
可视为沉淀完全)
您最近一年使用:0次
2022-08-15更新
|
772次组卷
|
3卷引用:广东省广州市省实、执信、广雅、六中四校2022-2023学年高三8月联考化学试题
广东省广州市省实、执信、广雅、六中四校2022-2023学年高三8月联考化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)广东省梅州市大埔县虎山中学2022-2023学年高三上学期11月月考化学试题
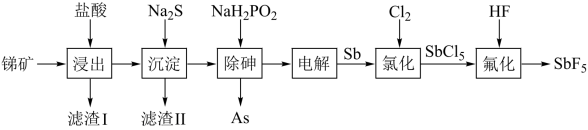
6 . 五氟化锑( )是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为 ,含有少量CuO、PbO、
,含有少量CuO、PbO、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
已知:I.CuS、PbS的 分别为
分别为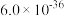 、
、 ;
;
Ⅱ. 微溶于水、
微溶于水、 难溶于水,它们均为两性氧化物;SbOCl难溶于水。
难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
(1)浸出时少量 转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为
转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为 ,不宜用NaOH溶液代替氨水的原因为
,不宜用NaOH溶液代替氨水的原因为_______ 。
(2)已知:浸出液中: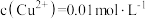 、
、 。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是
。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______ (填化学式);当CuS、PbS共沉时,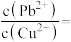
_______ 。
(3)“除砷”时, 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
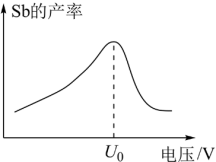
(4)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为_______ ;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是_______ 。
(5) 与
与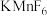 反应,首次实现了用化学方法制取
反应,首次实现了用化学方法制取 ,同时生成
,同时生成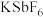 和
和 ,若生成33.6LF2(标准状况),则转移电子的数目为
,若生成33.6LF2(标准状况),则转移电子的数目为_______ (设 为阿伏加德罗常数)
为阿伏加德罗常数)
 )是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为 ,含有少量CuO、PbO、
,含有少量CuO、PbO、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
已知:I.CuS、PbS的
 分别为
分别为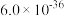 、
、 ;
;Ⅱ.
 微溶于水、
微溶于水、 难溶于水,它们均为两性氧化物;SbOCl难溶于水。
难溶于水,它们均为两性氧化物;SbOCl难溶于水。回答下列问题:
(1)浸出时少量
 转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为
转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为 ,不宜用NaOH溶液代替氨水的原因为
,不宜用NaOH溶液代替氨水的原因为(2)已知:浸出液中:
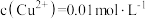 、
、 。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是
。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是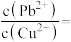
(3)“除砷”时,
 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(4)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为

(5)
 与
与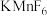 反应,首次实现了用化学方法制取
反应,首次实现了用化学方法制取 ,同时生成
,同时生成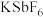 和
和 ,若生成33.6LF2(标准状况),则转移电子的数目为
,若生成33.6LF2(标准状况),则转移电子的数目为 为阿伏加德罗常数)
为阿伏加德罗常数)
您最近一年使用:0次
2022-05-27更新
|
597次组卷
|
2卷引用:广东省广州市广大附中、广外、铁一中学三校2022届高三三模联考化学试题
名校
解题方法
7 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
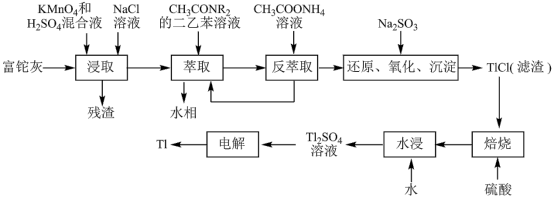
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
762次组卷
|
2卷引用:广东实验中学2022届高三下学期三模考前练笔化学试题
21-22高三上·广东广州·期末
8 . 铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。钼酸锂(Li2MoO4)的外观为白色结晶粉末,用于电极材料、金属陶瓷的制作。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉和制钼酸锂的流程如下图所示。
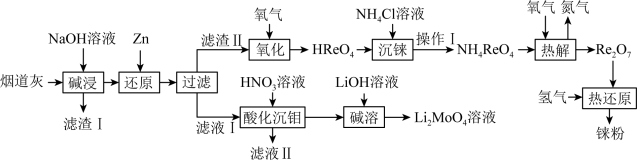
已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应_______ (填写化学方程式)、MoO3+2NaOH=NaMoO4+H2O,则“滤渣I”的主要成分为_______ (填化学式)。
(2)“还原”时,Zn被氧化成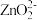 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___________ 。
(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___________ 、___________ 、洗涤、干燥。
(4)“热解”时,发生反应的化学方程式为___________ 。
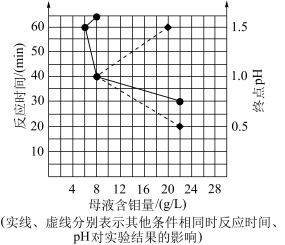
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为___________ min、pH为___________ 。
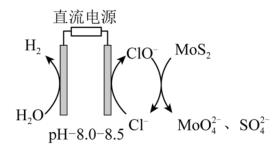
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为______ g。

已知:
I.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应
(2)“还原”时,Zn被氧化成
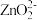 ,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为
,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括
(4)“热解”时,发生反应的化学方程式为
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据下图中数据判断最佳的“酸化沉钼”条件:反应时间为

(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为

您最近一年使用:0次
2022-03-08更新
|
857次组卷
|
6卷引用:广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题
(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题湖南省衡阳市第八中学2021-2022学年高三下学期开学考试(第六次月考)化学试题广东名校2021-2022学年高三下学期开学测试化学试题湖南省永州市第四中学2022届高三下学期期中考试化学试题湖南省株洲市第四中学2022-2023学年高三上学期第四次月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第二次月考化学试题
9 . 废旧锂离子电池经处理得到的正极活性粉体中含有Li2O、NiO、Co2O3、MnO2、Fe、C、Al等。从废旧锂离子电池中制备正极材料的前驱体(NiCO3·CoCO3·MnCO3)的工艺流程如图:

(1)“酸浸”温度为85℃,活性粉体中的钴(以Co2O3表示)还原浸出的化学方程式为____ ,该反应的还原剂是____ 。可用盐酸代替H2SO4和H2O2的混合液,但缺点是____ 。
(2)“除铁”时生成的黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:3:2:____ 。
(3)“除铝”时反应的离子方程式为____ 。
(4)从滤液中可提取____ (任写一种),其用途是____ 。

(1)“酸浸”温度为85℃,活性粉体中的钴(以Co2O3表示)还原浸出的化学方程式为
(2)“除铁”时生成的黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:3:2:
(3)“除铝”时反应的离子方程式为
(4)从滤液中可提取
您最近一年使用:0次
2022-01-23更新
|
241次组卷
|
2卷引用:广东省广州市海珠区2021-2022学年高一上学期期末考试化学试题
名校
解题方法
10 . 将铜锌合金溶解后与足量KI溶液反应(Zn2+不与 反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下:
反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下:
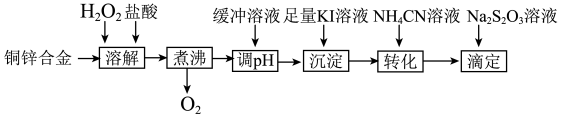
(1)“溶解”步骤中铜发生反应的离子方程式是_______ ,“煮沸”步骤的目的是_______ 。
(2)H2O2的电子式为_______ ,298K时,液态H2O2分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为_______ 。
(3)“缓冲溶液”是浓度均为0.10 的CH3COOH和CH3COONH4的混合溶液。25℃时,缓冲溶液中各种离子浓度由大到小的顺序为____。[25℃时,
的CH3COOH和CH3COONH4的混合溶液。25℃时,缓冲溶液中各种离子浓度由大到小的顺序为____。[25℃时, ]
]
(4)“调pH”步骤将溶液pH由1调到6,如果缺少这一步,对实验的影响为___ 。
(5)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为_______ 。
(6)“转化”步骤中,CuI转化为CuSCN。沉淀完全转化后,溶液中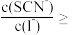
_______ 。[已知: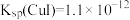 ;
; ]
]
 反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下:
反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下:
(1)“溶解”步骤中铜发生反应的离子方程式是
(2)H2O2的电子式为
(3)“缓冲溶液”是浓度均为0.10
 的CH3COOH和CH3COONH4的混合溶液。25℃时,缓冲溶液中各种离子浓度由大到小的顺序为____。[25℃时,
的CH3COOH和CH3COONH4的混合溶液。25℃时,缓冲溶液中各种离子浓度由大到小的顺序为____。[25℃时, ]
](4)“调pH”步骤将溶液pH由1调到6,如果缺少这一步,对实验的影响为
(5)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为
(6)“转化”步骤中,CuI转化为CuSCN。沉淀完全转化后,溶液中
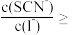
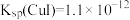 ;
; ]
]
您最近一年使用:0次
2022-01-23更新
|
194次组卷
|
2卷引用:广东省广州市天河区2021-2022学年高二上学期期末考试化学试题