1 . 下列离子方程式正确且与所给事实相符的是
A.某电子厂制作印刷电路板: |
B.用 溶液除去锅炉水垢中的 溶液除去锅炉水垢中的 : :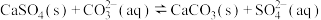 |
C.混用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)会发生氯气中毒: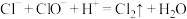 |
D.用 作抗胃酸药: 作抗胃酸药: |
您最近半年使用:0次
解题方法
2 . 镓( )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
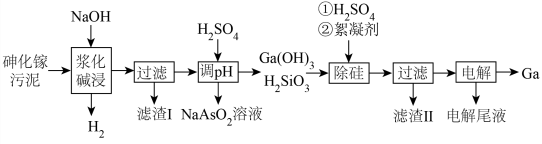
已知:Ⅰ.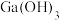 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;
Ⅱ. 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。
回答下列问题:
(1)“浆化碱浸”过程中 反应的离子方程式为
反应的离子方程式为________ ;“滤渣Ⅰ”的成分为______ (填化学式)。
(2)中和“调 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是_______ 。
(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的 调节至
调节至______ 范围内,沉淀效果最好;此过程中,加入絮凝剂的目的是_______ 。
(4) 溶液经
溶液经_________ 、______ 、抽滤、洗涤、干燥得 晶体。
晶体。
(5)用惰性电极电解得到电解尾液和 ,电解尾液可在
,电解尾液可在______ (填操作单元名称)过程中循环使用,提高经济效益。
(6) 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
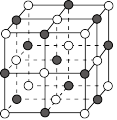
① 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为_____ 。
②距离最近的两个 原子之间的距离为
原子之间的距离为_______  (用含
(用含 的代数式表示)。
的代数式表示)。
 )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
已知:Ⅰ.
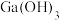 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;Ⅱ.
 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。回答下列问题:
(1)“浆化碱浸”过程中
 反应的离子方程式为
反应的离子方程式为(2)中和“调
 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的
 调节至
调节至 |  |  |
| 0.0 | 2500 | 1345 |
| 0.5 | 2456 | 1267 |
| 1.0 | 2438 | 81 |
| 1.5 | 2420 | 103 |
| 2.0 | 2200 | 804 |
| 2.5 | 1879 | 952 |
(4)
 溶液经
溶液经 晶体。
晶体。(5)用惰性电极电解得到电解尾液和
 ,电解尾液可在
,电解尾液可在(6)
 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
①
 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为②距离最近的两个
 原子之间的距离为
原子之间的距离为 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
3 . Ⅰ.MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图。回答下列问题:
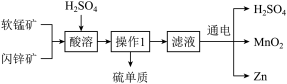
(1)能提高酸溶速率的措施为___________ 、___________ (任写两个)
(2)可循环使用的药品是___________ 。
(3)操作1为___________ 。
(4)酸溶时会生成硫酸锰,则化学反应方程式为___________ ;该反应中的氧化剂为___________ 。
Ⅱ.完成下列问题。
(5)某温度时,水的Kw=1×10-15,则该温度___________ (填“低于”“高于”或“等于”)25℃。
(6)常温下,将pH=2的盐酸与pH=13的KOH溶液混合后溶液pH=7,需盐酸和KOH的体积比为___________ 。
(7)常温下,pH=3的盐酸中水电离出的c水(H+)=_______ ;pH=12的NaOH溶液中c(OH-)=_____ 。

(1)能提高酸溶速率的措施为
(2)可循环使用的药品是
(3)操作1为
(4)酸溶时会生成硫酸锰,则化学反应方程式为
Ⅱ.完成下列问题。
(5)某温度时,水的Kw=1×10-15,则该温度
(6)常温下,将pH=2的盐酸与pH=13的KOH溶液混合后溶液pH=7,需盐酸和KOH的体积比为
(7)常温下,pH=3的盐酸中水电离出的c水(H+)=
您最近半年使用:0次
名校
4 . Ⅰ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)“服用维生素C,可以使食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有___________ (填“氧化”或“还原”)性。
(2)二氧化氯是一种高效消毒剂。工业制备 的反应为:
的反应为: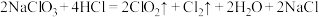 。
。
①氧化性:
___________ (填“>”或“<”) 。
。
② 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中可将
除去,下列试剂中可将 转化为
转化为 的是
的是___________ (填字母)。
a. b.
b. c.KI d.
c.KI d.
③先将下述反应配平,再用单线桥标出该反应中电子转移的方向和数目_______________ 。

Ⅱ.实验室可用 和浓盐酸反应制取氯气,反应原理如下:
和浓盐酸反应制取氯气,反应原理如下:
(3)用双线桥标出电子得失情况_______________ 。
(4)若参加反应的HCl是73g,则被氧化的HCl有___________ g(保留一位小数点)。
(5)某同学设计如下实验研究 的性质:
的性质:
能证明 具有还原性的实验是
具有还原性的实验是___________ (填序号)。可作为证据的实验现象是___________ (填字母序号)。
(1)“服用维生素C,可以使食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)二氧化氯是一种高效消毒剂。工业制备
 的反应为:
的反应为: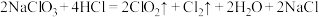 。
。①氧化性:

 。
。②
 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中可将
除去,下列试剂中可将 转化为
转化为 的是
的是a.
 b.
b. c.KI d.
c.KI d.
③先将下述反应配平,再用单线桥标出该反应中电子转移的方向和数目

Ⅱ.实验室可用
 和浓盐酸反应制取氯气,反应原理如下:
和浓盐酸反应制取氯气,反应原理如下:
(3)用双线桥标出电子得失情况
(4)若参加反应的HCl是73g,则被氧化的HCl有
(5)某同学设计如下实验研究
 的性质:
的性质:| 序号 | 实验 | 实验现象 |
| ⅰ | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ⅱ | 向5% 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 具有还原性的实验是
具有还原性的实验是
您最近半年使用:0次
名校
解题方法
5 . I.某化学兴趣小组利用如图所示装置进行“铁与水蒸气反应”的实验,并检验产物的性质。请回答下列问题:
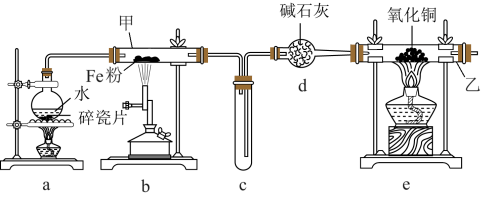
(1)整套装置中,先点燃___________ (填“a”或“b”)处的酒精灯或酒精喷灯,装置a的作用是 ___________ 。
(2)写出仪器甲中发生反应的化学方程式:___________ 。
(3)装置e的现象是___________ 。
II.设计如图实验方案确定反应后硬质玻璃管甲中黑色固体的成分(已知酸性KMnO4溶液能与盐酸 发生反应),待硬质玻璃管B冷却后,取少许其中的固体物质继续进行如图实验:

(4)试剂A是___________ 。
(5)若现象2为溶液紫红色变浅,请配平下列离子方程式:______________
_______Fe2+ +______ + ____= ______Fe3+ + _______Mn2+ + ______。
+ ____= ______Fe3+ + _______Mn2+ + ______。
(6)现象1为___________ 。
(7)实验室在配制FeCl2溶液时为避免其变质,需加入___________ (填物质名称)。

(1)整套装置中,先点燃
(2)写出仪器甲中发生反应的化学方程式:
(3)装置e的现象是
II.设计如图实验方案确定反应后硬质玻璃管甲中黑色固体的成分(已知酸性KMnO4溶液能与

(4)试剂A是
(5)若现象2为溶液紫红色变浅,请配平下列离子方程式:
_______Fe2+ +______
 + ____= ______Fe3+ + _______Mn2+ + ______。
+ ____= ______Fe3+ + _______Mn2+ + ______。(6)现象1为
(7)实验室在配制FeCl2溶液时为避免其变质,需加入
您最近半年使用:0次
2023-09-04更新
|
291次组卷
|
2卷引用:广东省梅州市大埔县虎山中学2023-2024学年高三上学期10月期中考试化学试题
名校
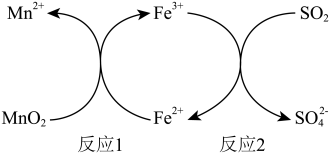
6 . 酸性条件下,用 进行脱硫处理的原理如下图所示。下列说法中,
进行脱硫处理的原理如下图所示。下列说法中,不正确 的是
 进行脱硫处理的原理如下图所示。下列说法中,
进行脱硫处理的原理如下图所示。下列说法中,
A.反应1中 做氧化剂 做氧化剂 | B.反应1的产物有 |
C.反应2中 做还原剂 做还原剂 | D.反应2中 做反应物 做反应物 |
您最近半年使用:0次
2023-07-18更新
|
385次组卷
|
5卷引用:广东省梅州市梅江区梅州中学2023-2024学年高一上学期第一次月考化学试题
名校
解题方法
7 . 下列离子方程式正确且能准确解释相应实验现象的是
A.向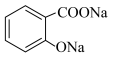 溶液中通入少量 溶液中通入少量 : :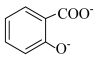 +CO2+H2O= +CO2+H2O=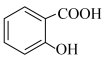 + + |
B.用白醋除铁锈: |
C.向Fe(SCN)3溶液中滴加NaF溶液,红色褪去: |
D.向淀粉KI溶液中通入 ,溶液变蓝并产生淡黄色沉淀: ,溶液变蓝并产生淡黄色沉淀: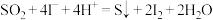 |
您最近半年使用:0次
2023-06-21更新
|
299次组卷
|
2卷引用:广东省梅州市大埔县虎山中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
8 . 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为 、
、 、
、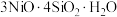 、
、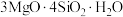 等)中回收Cu、Ni的工艺流程如图所示:
等)中回收Cu、Ni的工艺流程如图所示:
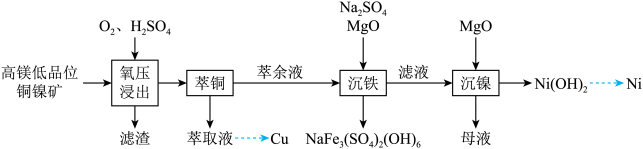
回答下列问题:
(1) 中,Fe元素的化合价为
中,Fe元素的化合价为_______ 。
(2)为提高“氧压浸出”的速率,可行的操作有_______ (任填一个)。
(3)“氧压浸出”的滤渣有S和_______ ,该环节中 发生的化学反应方程式为
发生的化学反应方程式为_______ 。
(4)已知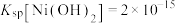 ,“滤液”中
,“滤液”中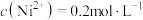 ,“沉镍”时,控制pH为8.50,此时
,“沉镍”时,控制pH为8.50,此时 的沉淀率为
的沉淀率为_______ ,“沉镍”后的母液,含有的主要溶质为_______ (填化学式)。
(5)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如下图所示:
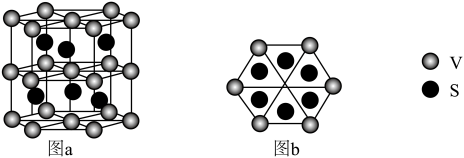
①该钒的硫化物的化学式是_______ 。
②该钒的硫化物的晶体中,与每个V原子最近且等距的S原子的个数是_______ 。
 、
、 、
、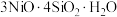 、
、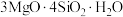 等)中回收Cu、Ni的工艺流程如图所示:
等)中回收Cu、Ni的工艺流程如图所示:
回答下列问题:
(1)
 中,Fe元素的化合价为
中,Fe元素的化合价为(2)为提高“氧压浸出”的速率,可行的操作有
(3)“氧压浸出”的滤渣有S和
 发生的化学反应方程式为
发生的化学反应方程式为(4)已知
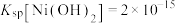 ,“滤液”中
,“滤液”中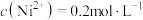 ,“沉镍”时,控制pH为8.50,此时
,“沉镍”时,控制pH为8.50,此时 的沉淀率为
的沉淀率为(5)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如下图所示:

①该钒的硫化物的化学式是
②该钒的硫化物的晶体中,与每个V原子最近且等距的S原子的个数是
您最近半年使用:0次
9 . 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。
(1)已知 能发生如下反应:
能发生如下反应: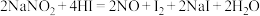 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:___________ 。
(2)
___________ (填“是”或“不是”)电解质,根据 中N的化合价是
中N的化合价是___________ ,推测 具有
具有___________ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(3)实验操作如表所示,请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
③通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_____________ 。
④写出实验3中发生反应的化学方程式:___________ 。
 )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。(1)已知
 能发生如下反应:
能发生如下反应: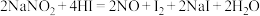 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:(2)

 中N的化合价是
中N的化合价是 具有
具有(3)实验操作如表所示,请完善表格中的实验现象和结论(已知
 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 | 结论 |
| 1 | 取 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有① 具有① |
| 2 | 取 溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为② 溶液,可观察到的实验现象为② |  具有还原性 具有还原性 |
| 3 |  固体与70%硫酸反应生成了NO和 固体与70%硫酸反应生成了NO和 两种气体 两种气体 |  具有氧化性和还原性 具有氧化性和还原性 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为④写出实验3中发生反应的化学方程式:
您最近半年使用:0次
2023-06-08更新
|
343次组卷
|
2卷引用:广东省梅州市五华县田家炳中学2022-2023学年高一上学期12月月考化学试题
名校
10 . 回答下列问题:
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是_______ (填化学式,下同); 被还原的元素是_______ ;氧化产物是_______ 。
②若有 96克 Cu 参与反应时,则生成的NO质量为_______ g。
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目_____ 。
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是_______ 。
②写出该反应的化学方程式_______ 。
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是
②若有 96克 Cu 参与反应时,则生成的NO质量为
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是
②写出该反应的化学方程式
您最近半年使用:0次



