解题方法
1 . 以萃铜余液为原料制备工业活性氧化锌,其生产工艺流程如图所示:
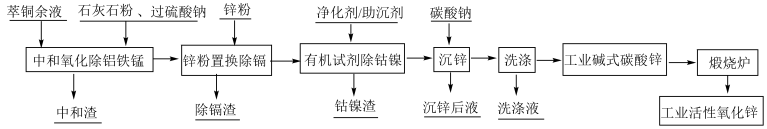
(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式_______ ;采用石灰石粉中和除去铝和铁,则中和渣中主要成分为_______ 。
(2)流程中用到最多的操作是_______ ,该操作中玻璃棒的作用是_______ 。
(3)用锌粉除镉(Cd2+ )的离子方程式为_______ ;沉锌生成碱式碳酸锌[2Zn(OH2)·ZnCO3·H2O]的化学方程式为_______ 。
(4)检验碱式碳酸锌洗涤干净的操作及现象为_______ 。
(5)煅烧炉中发生反应的化学方程式为_______ 。

(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式
(2)流程中用到最多的操作是
(3)用锌粉除镉(Cd2+ )的离子方程式为
(4)检验碱式碳酸锌洗涤干净的操作及现象为
(5)煅烧炉中发生反应的化学方程式为
您最近半年使用:0次
2 .  (亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备
(亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备 的流程如图所示,下列说法错误的是
的流程如图所示,下列说法错误的是

 (亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备
(亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备 的流程如图所示,下列说法错误的是
的流程如图所示,下列说法错误的是
A. 的漂白原理与 的漂白原理与 相似 相似 |
B.气体1、气体2分别是 、 、 |
C.反应3的离子方程式: |
| D.“分离”操作过程包括结晶、过滤、乙醇洗涤等 |
您最近半年使用:0次
2023-08-30更新
|
404次组卷
|
2卷引用:广东省阳江市2023-2024学年高二上学期10月月考化学试题
名校
3 . 下列离子方程式书写正确的是
A.将 固体投入 固体投入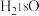 中: 中: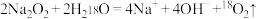 |
B.草酸加入酸性 溶液中: 溶液中: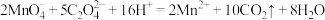 |
C.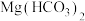 溶液与足量的 溶液与足量的 溶液反应: 溶液反应: |
D.向 溶液中滴加少量稀硫酸: 溶液中滴加少量稀硫酸: |
您最近半年使用:0次
2023-08-30更新
|
170次组卷
|
4卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题
名校
解题方法
4 . 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图。下列说法正确的是
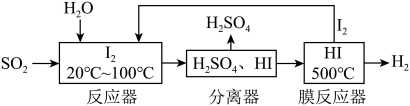

| A.分离器中的物质分离操作为过滤 |
| B.反应器中发生的氧化还原反应I2是还原剂 |
| C.该工艺中I2和HI的相互转化体现了“碘循环” |
| D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI |
您最近半年使用:0次
2023-08-29更新
|
127次组卷
|
2卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题
解题方法
5 . 某同学为了测定某生铁(仅含C、 )中铁的质量分数,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
)中铁的质量分数,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
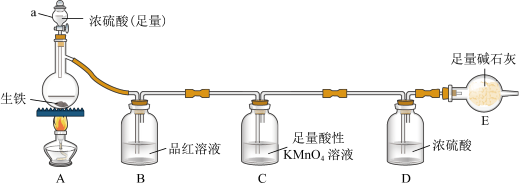
回答下列问题:
(1)仪器a的名称为_______ 。
(2)B装置中的现象为_______ ,C装置中的现象为_______ ,D装置的作用为_______ 。
(3)点燃酒精灯,A装置中杂质碳发生反应的化学方程式为_______ 。
(4)利用该装置测得实验结果不够准确,改良的方法为_______ 。
 )中铁的质量分数,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
)中铁的质量分数,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
回答下列问题:
(1)仪器a的名称为
(2)B装置中的现象为
(3)点燃酒精灯,A装置中杂质碳发生反应的化学方程式为
(4)利用该装置测得实验结果不够准确,改良的方法为
您最近半年使用:0次
2023-04-01更新
|
337次组卷
|
3卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题
6 . 将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
反应Ⅰ的化学方程式是_______ 。
②反应Ⅱ:_______ _______
_______
 +_______
+_______ +_______
+_______ (将反应补充完整)
(将反应补充完整)_______ 。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
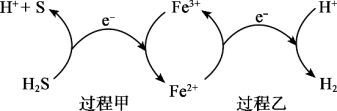
过程甲、乙中,氧化剂分别是_______ 、_______ 。
(3)按照设计,科研人员研究如下。
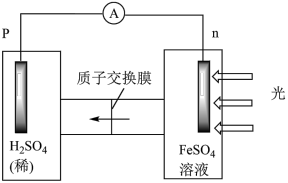
①首先研究过程乙是否可行,装置如图。经检验, 极区产生了Fe3+,
极区产生了Fe3+, 极产生了H2,
极产生了H2, 极区产生Fe3+的可能原因:
极区产生Fe3+的可能原因:
ⅰ.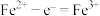
ⅱ.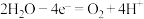 ,
,_______ (写离子方程式)。
经确认,ⅰ是产生Fe3+的原因。过程乙可行。
②光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。为研究S产生的原因,可以采用的操作是_______ 。经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ,Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
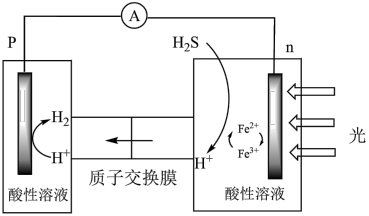
进一步研究发现,除了Fe3+/ Fe2+外, /I-也能实现如图所示循环过程。请说明
/I-也能实现如图所示循环过程。请说明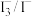 能够使S源源不断产生的原因:
能够使S源源不断产生的原因:_______ 。
(1)H2S的转化
| Ⅰ | 克劳斯法 | 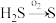 |
| Ⅱ | 铁盐氧化法 |  |
| Ⅲ | 光分解法 | 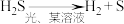 |
②反应Ⅱ:_______
 _______
_______
 +_______
+_______ +_______
+_______ (将反应补充完整)
(将反应补充完整)(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。

过程甲、乙中,氧化剂分别是
(3)按照设计,科研人员研究如下。
①首先研究过程乙是否可行,装置如图。经检验,
 极区产生了Fe3+,
极区产生了Fe3+, 极产生了H2,
极产生了H2, 极区产生Fe3+的可能原因:
极区产生Fe3+的可能原因:
ⅰ.
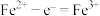
ⅱ.
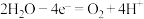 ,
,经确认,ⅰ是产生Fe3+的原因。过程乙可行。
②光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。为研究S产生的原因,可以采用的操作是
(4)综上,反应Ⅱ,Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。

进一步研究发现,除了Fe3+/ Fe2+外,
 /I-也能实现如图所示循环过程。请说明
/I-也能实现如图所示循环过程。请说明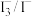 能够使S源源不断产生的原因:
能够使S源源不断产生的原因:
您最近半年使用:0次
2021-01-30更新
|
236次组卷
|
3卷引用:广东省阳江市高新区2022-2023学年高二上学期1月期末考试化学试题
7 . 黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。(M(FeS2)=120g/mol)
已知:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+
Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)将此方程式配平:_______________________________________________________________ H+
(2)样品中FeS2的质量分数是(假设杂质不参加反应)________________ 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________ L,制得98%的硫酸 质量为__________ t 。
已知:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+
Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)将此方程式配平:
(2)样品中FeS2的质量分数是(假设杂质不参加反应)
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为
您最近半年使用:0次
名校
解题方法
8 . 二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________ 。
(2)滤液1中加入H2O2溶液的目的是________________________________ 。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________ 。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式 ___________________________________ 。
(5)由滤液2生成Ce(OH)4的离子方程式 _____________________ 。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________ ,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________ (填“增强”或“降低”)。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是
(2)滤液1中加入H2O2溶液的目的是
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的
(5)由滤液2生成Ce(OH)4的
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:
您最近半年使用:0次
2017-09-07更新
|
531次组卷
|
2卷引用:广东省阳东广雅学校2018届高三11月月考化学试题



