名校
解题方法
1 . I.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
(1)结合上表的数据,写出工业上合成氨反应的热化学方程式_______ 。分离器中压强约为15MPa,温度约为-20°C,分离氨应用了氨的_____ 性质。
(2)在吸收塔中不断补充空气的目的是_____ 。
(3)吸收塔中出来的尾气会含有NO、NO2等氮氧化物,为了防止污染空气,通常有以下两种方法处理:
①Na2CO3溶液吸收法:反应原理为NO+NO2 + Na2CO3 =___ +CO2 (请完成化学方程式);根据反应,每产生22.4L(标准状况下)CO2,吸收液质量将增加____ g。
②氨催化还原法。以NO2为例,NH3可将NO2还原为无污染N2,该反应的方程式为____ 。

| 共价键 | N≡N | H−H | N−H |
| 断开1 mol共价键所需能量(kJ) | 946 | 436 | 391 |
(1)结合上表的数据,写出工业上合成氨反应的热化学方程式
(2)在吸收塔中不断补充空气的目的是
(3)吸收塔中出来的尾气会含有NO、NO2等氮氧化物,为了防止污染空气,通常有以下两种方法处理:
①Na2CO3溶液吸收法:反应原理为NO+NO2 + Na2CO3 =
②氨催化还原法。以NO2为例,NH3可将NO2还原为无污染N2,该反应的方程式为
您最近半年使用:0次
解题方法
2 . 小组同学探究 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。
实验:向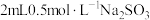 溶液中加入
溶液中加入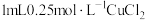 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。
已知:i.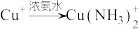 (无色)
(无色)
ii.
(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是 ,试剂
,试剂 是
是______ 。
②无色溶液在空气中放置变为深蓝色,反应的离子方程式为______ 。
(2)经检验,沉淀 不含
不含 。推测沉淀
。推测沉淀 能转化为沉淀
能转化为沉淀 与
与 有关,为研究沉淀
有关,为研究沉淀 的成分及沉淀
的成分及沉淀 转化为
转化为 的原因,实验如下。
的原因,实验如下。 中含有
中含有 ,补充实验:向少量洗净的沉淀
,补充实验:向少量洗净的沉淀 中加入稀硫酸,证实沉淀
中加入稀硫酸,证实沉淀 中含有
中含有 的现象是
的现象是______ 。
②无色溶液中含有 ,推测
,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验过程中 氧化
氧化 ;
;
途径2:______ (将途径补充完整)。
经研究,途径1不合理,途径2合理。
③解释 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:______ 。
(3) 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是______ 。
用 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
(4)根据上述实验得出 和
和 反应的结论:
反应的结论:______ 。(任答一点)
 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。实验:向
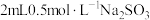 溶液中加入
溶液中加入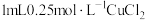 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。已知:i.
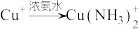 (无色)
(无色)ii.

(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是
 ,试剂
,试剂 是
是②无色溶液在空气中放置变为深蓝色,反应的离子方程式为
(2)经检验,沉淀
 不含
不含 。推测沉淀
。推测沉淀 能转化为沉淀
能转化为沉淀 与
与 有关,为研究沉淀
有关,为研究沉淀 的成分及沉淀
的成分及沉淀 转化为
转化为 的原因,实验如下。
的原因,实验如下。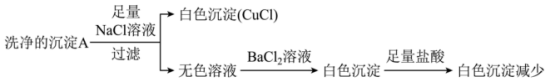
 中含有
中含有 ,补充实验:向少量洗净的沉淀
,补充实验:向少量洗净的沉淀 中加入稀硫酸,证实沉淀
中加入稀硫酸,证实沉淀 中含有
中含有 的现象是
的现象是②无色溶液中含有
 ,推测
,推测 的产生有两个途径:
的产生有两个途径:途径1:实验过程中
 氧化
氧化 ;
;途径2:
经研究,途径1不合理,途径2合理。
③解释
 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:(3)
 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是用
 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。(4)根据上述实验得出
 和
和 反应的结论:
反应的结论:
您最近半年使用:0次
3 . 某中学研究性学习小组的以黄铁矿 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程:
(1)在空气中焙烧黄铁矿的化学方程式为:__________________________ 。
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示( )。
)。__________ 。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式_____________________ 。检验反应Ⅱ所得的滤液中所含阴离子的方法是____________________________ 。
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得 的操作为:
的操作为:__________ 、__________ 、过滤、洗涤、干燥。
(5)反应①反应方程式是______________ 。从反应①至④制取高纯多晶硅的过程中可以循环利用的物质有____________________ 。
 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程: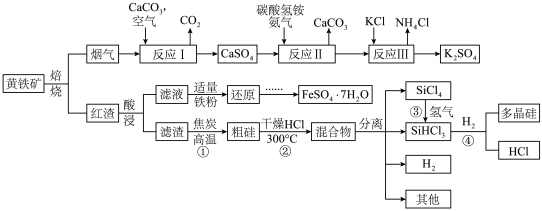
(1)在空气中焙烧黄铁矿的化学方程式为:
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示(
 )。
)。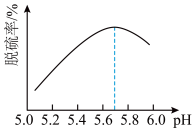
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得
 的操作为:
的操作为:(5)反应①反应方程式是
您最近半年使用:0次
名校
解题方法
4 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
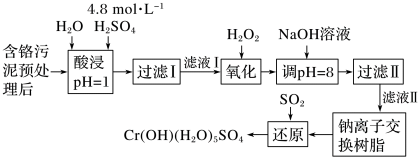
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_______ 、_______ 。(答出两点)
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为_______ 。
(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:_______ 。

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
 ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:
您最近半年使用:0次
名校
解题方法
5 . 氯化钠是一种非常重要钠盐。
I.实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。
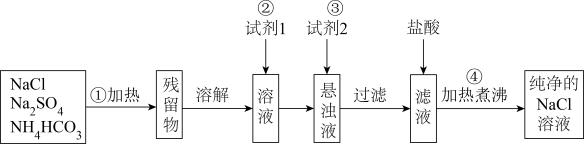
已知:操作①中发生的化学反应方程式为: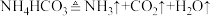
(1)试剂1最好为____________________ (填化学式)。
(2)加入试剂2的目的除去过量的试剂1中引进的杂质离子,写出加入试剂2发生反应的离子方程式:________________________________________ 。
(3)如何检验产品中的溶质为NaCl:______________________________ 。
II. 是一种化工原料,如图所示可以制备一系列物质
是一种化工原料,如图所示可以制备一系列物质
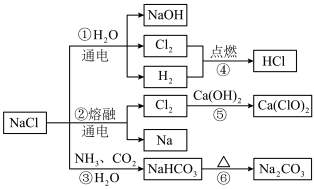
(4)图所列转化反应中属于氧化还原反应的有__________ (填图中序号)。
电解氯化钠溶液发生反应的离子方程式为______________________________ 。
(5)用单线桥分析电解熔融氯化钠时电子转移情况:______________________________ 。

(6)反应③是侯氏制碱法的原理,反应⑥的化学方程式为:______________________________ 。
I.实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。

已知:操作①中发生的化学反应方程式为:
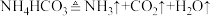
(1)试剂1最好为
(2)加入试剂2的目的除去过量的试剂1中引进的杂质离子,写出加入试剂2发生反应的离子方程式:
(3)如何检验产品中的溶质为NaCl:
II.
 是一种化工原料,如图所示可以制备一系列物质
是一种化工原料,如图所示可以制备一系列物质
(4)图所列转化反应中属于氧化还原反应的有
电解氯化钠溶液发生反应的离子方程式为
(5)用单线桥分析电解熔融氯化钠时电子转移情况:

(6)反应③是侯氏制碱法的原理,反应⑥的化学方程式为:
您最近半年使用:0次
名校
6 . 完成下列问题。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为 )与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为
)与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为_________ 。某同学拟用该原理按如下装置制备并收集纯净的氯气,在虚线框内选用的发生装置_________ (填“甲”“乙”或“丙”)。
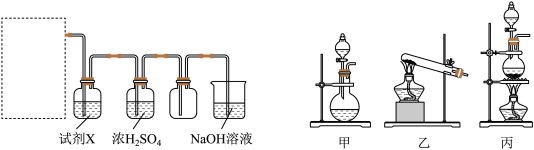
试剂X是________ 。可用NaOH溶液吸收尾气,反应的离子方程式为_______ 。
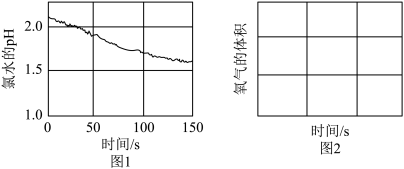
(2)通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是___________ (请用化学方程式说明),请在图2中画出氧气的体积随时间变化的趋势图___________ 。
(3)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠( )溶液可制备新的绿色消毒剂二氧化氯(
)溶液可制备新的绿色消毒剂二氧化氯( ),反应中还可得到氯化钠。该反应的化学方程式为
),反应中还可得到氯化钠。该反应的化学方程式为__________ 。
(4)随着科技的进步,科学家们又发现一种新型绿色消毒剂高铁酸钠。工业上制备高铁酸钠的一种方法的离子方程式为: 。分析
。分析 中Fe元素的化合价推测该微粒具有的性质
中Fe元素的化合价推测该微粒具有的性质__________ 。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为
 )与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为
)与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为
试剂X是
(2)通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是

(3)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠(
 )溶液可制备新的绿色消毒剂二氧化氯(
)溶液可制备新的绿色消毒剂二氧化氯( ),反应中还可得到氯化钠。该反应的化学方程式为
),反应中还可得到氯化钠。该反应的化学方程式为(4)随着科技的进步,科学家们又发现一种新型绿色消毒剂高铁酸钠。工业上制备高铁酸钠的一种方法的离子方程式为:
 。分析
。分析 中Fe元素的化合价推测该微粒具有的性质
中Fe元素的化合价推测该微粒具有的性质
您最近半年使用:0次
名校
解题方法
7 . 某化工厂从含 的废料(杂质为
的废料(杂质为 )中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍(NiOOH))的工艺流程如下图:
)中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍(NiOOH))的工艺流程如下图:
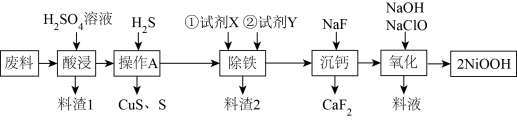
(1)“酸浸”中不断用搅拌机进行搅拌的目的是___________ ;料渣1的主要成分是___________ (填化学式)
(2)“除铁”中试剂X常用过氧化氢溶液,写出其除铁反应中,氧化剂与还原剂物质的量之比___________ ;试剂Y用于调节溶液的 ,根据下列数据,则
,根据下列数据,则 的调控范围是
的调控范围是___________ 。
(3)写出“氧化”步骤中反应的离子方程式:___________
(4)“沉钙”中当溶液中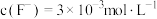 ,通过计算确定溶液中
,通过计算确定溶液中 是否沉淀完全。
是否沉淀完全。_______ [常温时, ;当离子浓度小于
;当离子浓度小于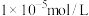 时,认为完全沉淀]
时,认为完全沉淀]
 的废料(杂质为
的废料(杂质为 )中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍(NiOOH))的工艺流程如下图:
)中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍(NiOOH))的工艺流程如下图:
(1)“酸浸”中不断用搅拌机进行搅拌的目的是
(2)“除铁”中试剂X常用过氧化氢溶液,写出其除铁反应中,氧化剂与还原剂物质的量之比
 ,根据下列数据,则
,根据下列数据,则 的调控范围是
的调控范围是| 离子 |  |  |  |
开始沉淀的 | 1.5 | 6.5 | 7.2 |
沉淀完全的 | 3.2 | 9.7 | 9.2 |
(3)写出“氧化”步骤中反应的离子方程式:
(4)“沉钙”中当溶液中
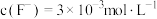 ,通过计算确定溶液中
,通过计算确定溶液中 是否沉淀完全。
是否沉淀完全。 ;当离子浓度小于
;当离子浓度小于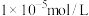 时,认为完全沉淀]
时,认为完全沉淀]
您最近半年使用:0次
名校
解题方法
8 . 几种常见其化合物:Na、 、
、 、
、 、NaOH、
、NaOH、 。回答下列问题:
。回答下列问题:
(1)属于钠盐是___________ 。
(2)写出 的一种用途:
的一种用途:___________ 。
(3)向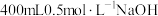 溶液中通入
溶液中通入 3.36L(标准状况),发生反应的离子方程式为
3.36L(标准状况),发生反应的离子方程式为___________ 。
(4)在密闭容器中,将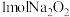 和
和 固体混合物加热至250℃,充分反应后,残留固体为
固体混合物加热至250℃,充分反应后,残留固体为___________ 。
(5)铁酸盐(钠、钾)为六价铁盐,是一种新型消毒剂。干法制备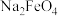 的主要反应化学方程式为
的主要反应化学方程式为 ___________
___________ ___________
___________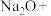 ___________
___________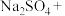 ___________,完成并配平该方程式
___________,完成并配平该方程式_______ 。
 、
、 、
、 、NaOH、
、NaOH、 。回答下列问题:
。回答下列问题:(1)属于钠盐是
(2)写出
 的一种用途:
的一种用途:(3)向
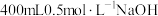 溶液中通入
溶液中通入 3.36L(标准状况),发生反应的离子方程式为
3.36L(标准状况),发生反应的离子方程式为(4)在密闭容器中,将
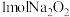 和
和 固体混合物加热至250℃,充分反应后,残留固体为
固体混合物加热至250℃,充分反应后,残留固体为(5)铁酸盐(钠、钾)为六价铁盐,是一种新型消毒剂。干法制备
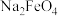 的主要反应化学方程式为
的主要反应化学方程式为 ___________
___________ ___________
___________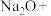 ___________
___________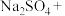 ___________,完成并配平该方程式
___________,完成并配平该方程式
您最近半年使用:0次
9 . 少量 与
与 溶液能发生如下反应:
溶液能发生如下反应: (方程式未配平),设
(方程式未配平),设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
A.1L 1  溶液含 溶液含 的数目为2 的数目为2 | B.1mol  可制得 可制得 的胶粒数为 的胶粒数为 |
C.78g  含有共价键的数目为 含有共价键的数目为 | D.每生成1mol X,转移的电子数为 |
您最近半年使用:0次
2023-12-01更新
|
153次组卷
|
6卷引用:广东省江门市2024届高三上学期9月金太阳联考化学试题
10 . 某工厂以辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)和软锰矿(主要成分为
杂质)和软锰矿(主要成分为 )为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
)为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
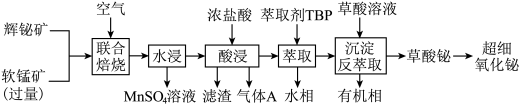
已知:①联合焙烧时 、
、 转变为
转变为 、
、 ;
;
② 易与
易与 形成
形成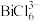 ,
,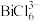 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: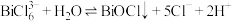
(1)Bi位于元素周期表第六周期第ⅤA族,其价层电子排布式为___________ 。
(2)写出“联合焙烧”时 和
和 反应的化学方程式
反应的化学方程式___________ 。
(3)若焙烧时 过量可分解为
过量可分解为 ,则“酸浸”时
,则“酸浸”时 会转化为
会转化为 ,此时生成的气体A为
,此时生成的气体A为___________ 。(填化学式)
(4)“酸浸”时需及时补充浓盐酸调节酸浸液的pH小于1.4,其目的是___________ 。
(5)铋离子能被有机萃取剂TBP萃取,其萃取原理可表示为: ,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是
,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是___________ 。

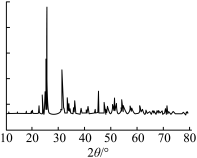
(6)沉淀反萃取所得草酸铋[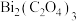 ]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了
]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了 的明锐衍射峰。
的明锐衍射峰。
① 属于
属于___________ (填“晶体”或“非晶体”)
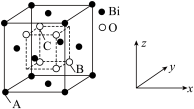
② 的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (
的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (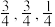 ),则C点坐标为
),则C点坐标为___________ ,若晶胞中两个Bi原子的最近距离为anm,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含有
,含有 、
、 杂质)和软锰矿(主要成分为
杂质)和软锰矿(主要成分为 )为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
)为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
已知:①联合焙烧时
 、
、 转变为
转变为 、
、 ;
;②
 易与
易与 形成
形成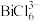 ,
,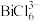 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: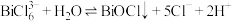
(1)Bi位于元素周期表第六周期第ⅤA族,其价层电子排布式为
(2)写出“联合焙烧”时
 和
和 反应的化学方程式
反应的化学方程式(3)若焙烧时
 过量可分解为
过量可分解为 ,则“酸浸”时
,则“酸浸”时 会转化为
会转化为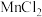 ,此时生成的气体A为
,此时生成的气体A为(4)“酸浸”时需及时补充浓盐酸调节酸浸液的pH小于1.4,其目的是
(5)铋离子能被有机萃取剂TBP萃取,其萃取原理可表示为:
 ,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是
,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是
(6)沉淀反萃取所得草酸铋[
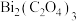 ]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了
]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了 的明锐衍射峰。
的明锐衍射峰。
①
 属于
属于②
 的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (
的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (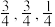 ),则C点坐标为
),则C点坐标为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次



