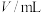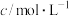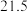名校
解题方法
1 . 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NO2反应进行了探究。某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。回答下列问题:___________ ;B中圆底烧瓶收集氨气时,请你选择氨气的进气口___________ (填“a”或“b”)。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气极易溶于水且水溶液显___________ 性。
(3)将前面收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子 、
、 夹好)。
夹好)。___________ 。
(4)NO2与水反应的化学方程式___________ ,其中氧化剂与还原剂的物质的量之比是___________ 。
(5)久置的浓HNO3呈黄色的原因是?用化学方程式解释___________ 。
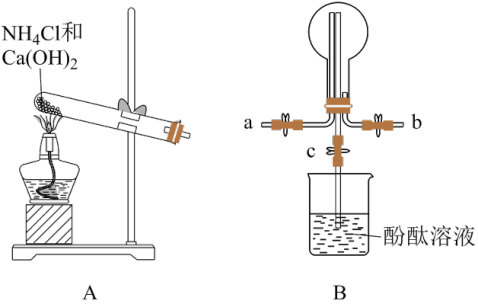
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气极易溶于水且水溶液显
(3)将前面收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子
 、
、 夹好)。
夹好)。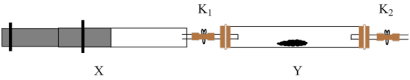
(4)NO2与水反应的化学方程式
(5)久置的浓HNO3呈黄色的原因是?用化学方程式解释
您最近半年使用:0次
解题方法
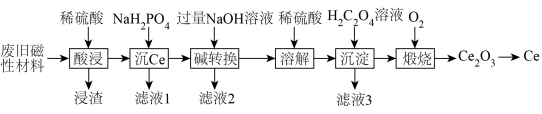
2 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
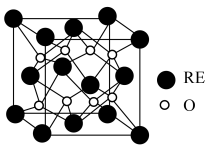
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近半年使用:0次
名校
解题方法
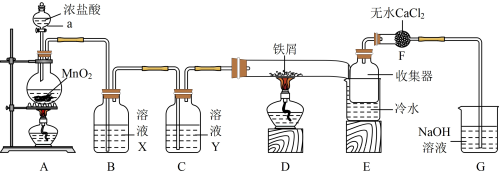
3 . 已知无水FeCl3在空气中易潮解,加热易升华。实验室利用如图所示实验装置制取无水FeCl3(加热和夹持装置略去)。
回答下列问题:
(1)装置A发生反应的化学方程式为___________ ,该反应氧化剂还原剂个数比___________ ,电子转移的总数为___________ 。
(2)装置D发生反应的化学方程式为___________ 。
(3)实验结束时,应先熄灭___________ (填“A”或“D”)处酒精灯;E中冷水的作用是___________ 。
(4)装置F的作用是___________ ;装置G发生反应的离子方程式___________ 。

回答下列问题:
(1)装置A发生反应的化学方程式为
(2)装置D发生反应的化学方程式为
(3)实验结束时,应先熄灭
(4)装置F的作用是
您最近半年使用:0次
名校
解题方法
4 . 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,易与水发生氧化还原反应,可利用反应CS2+3Cl2 CCl4+S2Cl2进行制备。下列说法
CCl4+S2Cl2进行制备。下列说法不正确 的是
 CCl4+S2Cl2进行制备。下列说法
CCl4+S2Cl2进行制备。下列说法| 物质的熔沸点 | |||
| 物质 | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 47 | 77 | 137 |
| 熔点/℃ | -109 | -23 | -77 |
| A.制备反应中各物质在固态时晶体类型完全相同 |
| B.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 |
| C.CS2、CCl4、S2Cl2熔沸点的高低是由共价键的键能决定 |
| D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
您最近半年使用:0次
2023-06-21更新
|
192次组卷
|
3卷引用:广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题
解题方法
5 . 利用油脂厂废弃的镍(Ni)催化剂(主要含有Ni、Al、Fe及少量NiO、 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下:
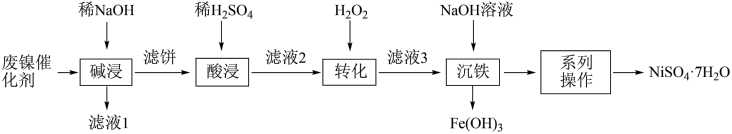
回答下列问题:
(1)为加快“碱浸”的速率可采取的措施是___________ (任写一条);“碱浸”中NaOH的作用有:去除油脂、___________ 。
(2)“滤液2”中含金属阳离子,主要有:___________ 。
(3)①“转化”中反应的离子方程式是___________ ;
②“转化”中可替代 的最佳物质是
的最佳物质是___________ (填标号)。
a、 b、
b、 c、Fe
c、Fe
(4)得到 的系列操作中不包含下列哪个___________
的系列操作中不包含下列哪个___________
 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)为加快“碱浸”的速率可采取的措施是
(2)“滤液2”中含金属阳离子,主要有:
(3)①“转化”中反应的离子方程式是
②“转化”中可替代
 的最佳物质是
的最佳物质是a、
 b、
b、 c、Fe
c、Fe(4)得到
 的系列操作中不包含下列哪个___________
的系列操作中不包含下列哪个___________| A.蒸发浓缩 | B.过滤 | C.洗涤 | D.蒸馏 |
您最近半年使用:0次
名校
解题方法
6 . 下列反应的离子方程式书写正确的是
| A.将氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.向CuSO4溶液中加入Na2O2;2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
| C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
D.向稀HNO3中滴加Na2SO3溶液:SO +2H+=SO2↑+H2O +2H+=SO2↑+H2O |
您最近半年使用:0次
名校
7 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)①通过A、B,可探究出____ (填外部因素)的改变对化学反应速率的影响,其中V1=_____ ;
②通过B和C,可探究出_____ (填外部因素)的变化对化学反应速率的影响,其中V2=____ 。
(2)若t1<8,则由此实验可以得出的结论是_______ ;
(3)写出该反应的离子方程式_______ 。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
结合实验目的与表中数据,你得出的结论是_______ 。从影响化学反应速率的因素看,你认为还可能是_______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_______ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
| 实验 序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
②通过B和C,可探究出
(2)若t1<8,则由此实验可以得出的结论是
(3)写出该反应的离子方程式
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| 温度/℃ | 20 | 21 | 21 | 21.5 | 22 | 22 |
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
您最近半年使用:0次
名校
解题方法
8 . 镍是一种重要的战略性金属,利用红土镍矿(含 、
、 、
、 、
、 )综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
)综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
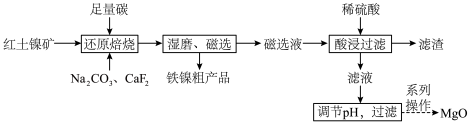
已知:存在未成对电子的金属原子(离子)具有顺磁性,顺磁性的磁矩不为0,反磁性的磁矩为0。
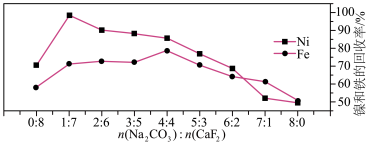
(1)根据图数据可知,添加剂中 与
与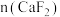 之比为
之比为__________ 时,有利于镍和铁的回收。
(2)写出“还原焙烧”得到铁单质的化学方程式:__________ 。
(3)“磁选”利用物质具有顺磁性,磁矩μ与未成对电子数n的关系为 ,则μ(铁原子)
,则μ(铁原子)__________ (填“<”或“>”) μ(镍原子)。
(4)滤渣的主要成分为__________ (化学式)。
(5)已知 、
、 均为离子晶体,离子半径
均为离子晶体,离子半径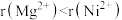 ,则根据上述信息可预测熔点
,则根据上述信息可预测熔点
__________ (填“>”或“<”) ;某缺陷氧化镍的组成为
;某缺陷氧化镍的组成为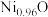 ,其中
,其中 元素只有
元素只有 、
、 两种价态,则两种价态的镍离子数目之比为
两种价态,则两种价态的镍离子数目之比为__________ 。
(6)工业上常用 与足量的碳在氯气的环境下加热生产
与足量的碳在氯气的环境下加热生产 ,若生产
,若生产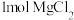 转移电子的物质的量为
转移电子的物质的量为 ,写出此过程的化学方程式:
,写出此过程的化学方程式:__________ 。
 、
、 、
、 、
、 )综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
)综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
已知:存在未成对电子的金属原子(离子)具有顺磁性,顺磁性的磁矩不为0,反磁性的磁矩为0。
(1)根据图数据可知,添加剂中
 与
与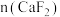 之比为
之比为
(2)写出“还原焙烧”得到铁单质的化学方程式:
(3)“磁选”利用物质具有顺磁性,磁矩μ与未成对电子数n的关系为
 ,则μ(铁原子)
,则μ(铁原子)(4)滤渣的主要成分为
(5)已知
 、
、 均为离子晶体,离子半径
均为离子晶体,离子半径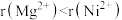 ,则根据上述信息可预测熔点
,则根据上述信息可预测熔点
 ;某缺陷氧化镍的组成为
;某缺陷氧化镍的组成为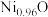 ,其中
,其中 元素只有
元素只有 、
、 两种价态,则两种价态的镍离子数目之比为
两种价态,则两种价态的镍离子数目之比为(6)工业上常用
 与足量的碳在氯气的环境下加热生产
与足量的碳在氯气的环境下加热生产 ,若生产
,若生产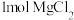 转移电子的物质的量为
转移电子的物质的量为 ,写出此过程的化学方程式:
,写出此过程的化学方程式:
您最近半年使用:0次
名校
9 . 某小组同学欲探究H2O2的化学性质,经历如下探究过程:
预测:H2O2中的O作为核心元素,预测H2O2既具有氧化性,也具有还原性。
(1)预测H2O2既具有氧化性,也具有还原性的依据是_______ 。
实验观察:小组同学分别选用酸性KMnO4溶液、酸性KI溶液、酸性FeCl2溶液与5% H2O2溶液反应以验证预测。(已知淀粉溶液遇碘单质变蓝 )
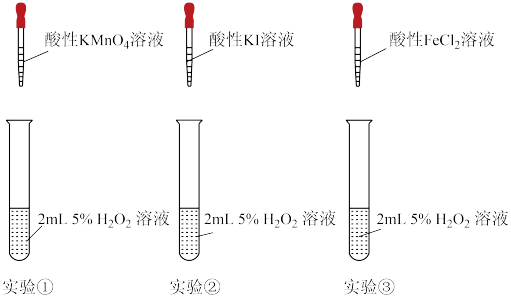
(2)实验①观察到溶液褪色,同时有气泡冒出。KMnO4在反应中表现_______ 性(填“氧化”或“还原”),该反应的离子方程式为_______ 。
(3)在实验②反应后的溶液中加入淀粉溶液,可观察到溶液变蓝。加入酸性KI溶液后,反应的离子方程式为_______ 。
(4)实验③观察到溶液变为黄色,该反应的离子方程式为_______ ;一段时间后,溶液中有气泡出现,原因是_______ 。
结论:H2O2既具有氧化性,也具有还原性。
(5)H2O2常称为“绿色氧化剂”的原因是_______ 。
预测:H2O2中的O作为核心元素,预测H2O2既具有氧化性,也具有还原性。
(1)预测H2O2既具有氧化性,也具有还原性的依据是
实验观察:小组同学分别选用酸性KMnO4溶液、酸性KI溶液、酸性FeCl2溶液与5% H2O2溶液反应以验证预测。(已知淀粉溶液遇碘单质变蓝 )

(2)实验①观察到溶液褪色,同时有气泡冒出。KMnO4在反应中表现
(3)在实验②反应后的溶液中加入淀粉溶液,可观察到溶液变蓝。加入酸性KI溶液后,反应的离子方程式为
(4)实验③观察到溶液变为黄色,该反应的离子方程式为
结论:H2O2既具有氧化性,也具有还原性。
(5)H2O2常称为“绿色氧化剂”的原因是
您最近半年使用:0次
2022-10-15更新
|
139次组卷
|
2卷引用:广东省德庆县香山中学2023-2024学年高一上学期9月月考化学试题
名校
10 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
回答下列问题:
(1)通过实验A、B,可探究________ 的改变对反应速率的影响,其中
________ ,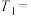
________ ;通过实验________ (填序号)可探究出温度变化对化学反应速率的影响。
(2)若 、
、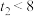 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是________ ;利用实验B中数据计算,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
_________ 。
(3)写出该反应的离子方程式______________ 。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
结合实验目的与表中数据,你得出的结论是______________ 。
从影响化学反应速率的因素看,你认为还可能是______________ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是______________ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
|
|
| |||||
|
|
|
|
| |||
A | 293 | 2 |
| 4 |
| 0 |
|
B |
| 2 |
| 3 |
|
| 8 |
C | 313 | 2 |
|
|
| 0 |
|
(1)通过实验A、B,可探究

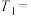
(2)若
 、
、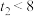 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率
的浓度变化表示的反应速率
(3)写出该反应的离子方程式
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
温度/ | 20 | 21 | 21 |
| 22 | 22 |
从影响化学反应速率的因素看,你认为还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
您最近半年使用:0次
2022-01-18更新
|
364次组卷
|
4卷引用:广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题