名校
解题方法
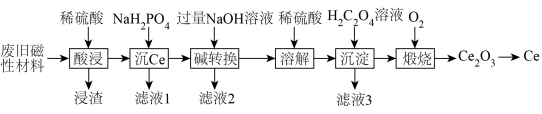
1 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
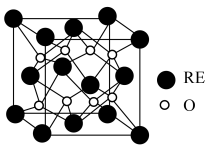
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近一年使用:0次
2024-03-31更新
|
1052次组卷
|
4卷引用:2024届广东省肇庆市高三上学期二模化学试题
2024届广东省肇庆市高三上学期二模化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(广东卷02)-2024年高考押题预测卷2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题
名校
解题方法
2 . 下列反应的离子方程式书写正确的是
| A.将氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.向CuSO4溶液中加入Na2O2;2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
| C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
D.向稀HNO3中滴加Na2SO3溶液:SO +2H+=SO2↑+H2O +2H+=SO2↑+H2O |
您最近一年使用:0次
名校
解题方法
3 . 镍是一种重要的战略性金属,利用红土镍矿(含 、
、 、
、 、
、 )综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
)综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
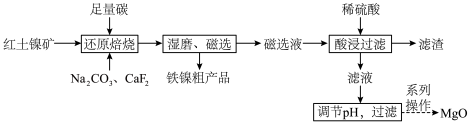
已知:存在未成对电子的金属原子(离子)具有顺磁性,顺磁性的磁矩不为0,反磁性的磁矩为0。
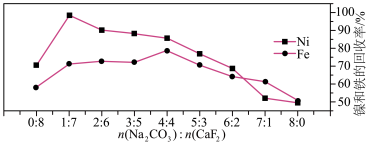
(1)根据图数据可知,添加剂中 与
与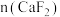 之比为
之比为__________ 时,有利于镍和铁的回收。
(2)写出“还原焙烧”得到铁单质的化学方程式:__________ 。
(3)“磁选”利用物质具有顺磁性,磁矩μ与未成对电子数n的关系为 ,则μ(铁原子)
,则μ(铁原子)__________ (填“<”或“>”) μ(镍原子)。
(4)滤渣的主要成分为__________ (化学式)。
(5)已知 、
、 均为离子晶体,离子半径
均为离子晶体,离子半径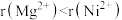 ,则根据上述信息可预测熔点
,则根据上述信息可预测熔点
__________ (填“>”或“<”) ;某缺陷氧化镍的组成为
;某缺陷氧化镍的组成为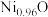 ,其中
,其中 元素只有
元素只有 、
、 两种价态,则两种价态的镍离子数目之比为
两种价态,则两种价态的镍离子数目之比为__________ 。
(6)工业上常用 与足量的碳在氯气的环境下加热生产
与足量的碳在氯气的环境下加热生产 ,若生产
,若生产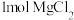 转移电子的物质的量为
转移电子的物质的量为 ,写出此过程的化学方程式:
,写出此过程的化学方程式:__________ 。
 、
、 、
、 、
、 )综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
)综合回收镍、铁、镁是重要的工业冶炼工艺,部分流程如下:
已知:存在未成对电子的金属原子(离子)具有顺磁性,顺磁性的磁矩不为0,反磁性的磁矩为0。
(1)根据图数据可知,添加剂中
 与
与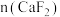 之比为
之比为
(2)写出“还原焙烧”得到铁单质的化学方程式:
(3)“磁选”利用物质具有顺磁性,磁矩μ与未成对电子数n的关系为
 ,则μ(铁原子)
,则μ(铁原子)(4)滤渣的主要成分为
(5)已知
 、
、 均为离子晶体,离子半径
均为离子晶体,离子半径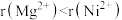 ,则根据上述信息可预测熔点
,则根据上述信息可预测熔点
 ;某缺陷氧化镍的组成为
;某缺陷氧化镍的组成为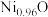 ,其中
,其中 元素只有
元素只有 、
、 两种价态,则两种价态的镍离子数目之比为
两种价态,则两种价态的镍离子数目之比为(6)工业上常用
 与足量的碳在氯气的环境下加热生产
与足量的碳在氯气的环境下加热生产 ,若生产
,若生产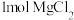 转移电子的物质的量为
转移电子的物质的量为 ,写出此过程的化学方程式:
,写出此过程的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 为解决国家“973计划”中钒、铬资源的利用问题,2013年6月攀钢成立“钒铬渣分离提取钒铬技术研究”课题组,2020年5月课题组公布了提取钒铬的工艺流程:
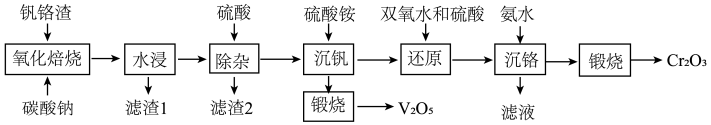
已知:
①钒铬渣中含有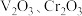 ,及
,及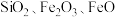 等;
等;
② 时,
时, 的溶度积常数为
的溶度积常数为 ;
;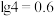 。
。
回答下列问题:
(1)“氧化焙烧”时,钒铬渣中化合价发生变化的元素为铬及______ (用元素名称表示)。
(2)为加快“水浸”速率,可采取的措施为______ (写出一种即可)。
(3)“除杂”产生的滤渣2的成分是______ (用化学式表示)。
(4)写出“煅烧”时反应的化学方程式______ (已知“沉钒”时析出正五价钒的含氧酸铵盐)。
(5)“还原”溶液中的 时发生反应的离子方程式为
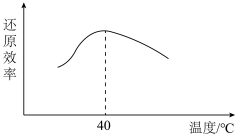
时发生反应的离子方程式为______ ,已知双氧水还原 的效率与温度的关系如图,分析
的效率与温度的关系如图,分析 时,双氧水还原效率最高的原因
时,双氧水还原效率最高的原因______ 。
(6)“沉铬”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=______ (已知溶液中离子浓度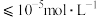 时认为已完全沉淀)。
时认为已完全沉淀)。

已知:
①钒铬渣中含有
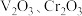 ,及
,及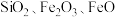 等;
等;②
 时,
时, 的溶度积常数为
的溶度积常数为 ;
; 。
。回答下列问题:
(1)“氧化焙烧”时,钒铬渣中化合价发生变化的元素为铬及
(2)为加快“水浸”速率,可采取的措施为
(3)“除杂”产生的滤渣2的成分是
(4)写出“煅烧”时反应的化学方程式
(5)“还原”溶液中的
 时发生反应的离子方程式为
时发生反应的离子方程式为 的效率与温度的关系如图,分析
的效率与温度的关系如图,分析 时,双氧水还原效率最高的原因
时,双氧水还原效率最高的原因(6)“沉铬”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=
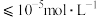 时认为已完全沉淀)。
时认为已完全沉淀)。
您最近一年使用:0次
2021-03-20更新
|
1906次组卷
|
10卷引用:广东省肇庆市2021届高三第二次统一测试(二模)化学试题
广东省肇庆市2021届高三第二次统一测试(二模)化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)微专题18 金属及其化合物制备流程(V)-备战2022年高考化学考点微专题(已下线)微专题18 金属及其化合物制备流程(Cr)-备战2022年高考化学考点微专题2021年辽宁高考化学试题变式题11-19河北省石家庄市第二中学西校区2021-2022学年高三下学期4月月考化学试题湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)2022年全国甲卷高考真题变式题(非选择题)甘肃省张掖市2022-2023学年高三上学期第一次诊断考试化学试题江西省九江第一中学2021-2022学年高二下学期5月月考化学试题
解题方法
5 . 已知:As2O3、锌和稀硫酸反应会生成AsH3、硫酸锌和水。现将4.0mg含As2O3的试样和锌、稀硫酸混合恰好完全反应,将生成的AsH3缓慢通过热玻璃管中,AsH3完全分解冷却后得到3mg固体。下列有关说法不正确的是
| A.试样中As2O3的质量分数为99% |
| B.参与反应的锌失去的电子数为1.210-4NA |
| C.分解产生的氢气在标准状况下体积为1.344mL |
| D.若硫酸的物质的量浓度为0.12mol/L,则消耗稀硫酸的体积为1mL |
您最近一年使用:0次
2021-01-21更新
|
211次组卷
|
2卷引用:广东省肇庆市百花中学2021届高三下学期5月模拟考试化学试题
6 . 过氧硫酸氢钾复合盐(K2SO4•KHSO4•2KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。某研究小组制备过氧硫酸氢钾复合盐的流程如图所示。

已知:浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为________ ;工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为___________________________ 。
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是___________________________ 。
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为______________________________ 。过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示,则该过程适宜的条件是_________________ 。

(4)产品中KHSO5含量的测定:取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:2KHSO5+4KI+H2SO4 = 2I2+3K2SO4+2H2O I2+2Na2S2O3 =Na2S4O6+2NaI

①用_____ 滴定管盛装标准浓度的硫代硫酸钠溶液(填“甲”或“乙”)。
②产品中KHSO5的质量分数为___________ 。

已知:浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为

(4)产品中KHSO5含量的测定:取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:2KHSO5+4KI+H2SO4 = 2I2+3K2SO4+2H2O I2+2Na2S2O3 =Na2S4O6+2NaI

①用
②产品中KHSO5的质量分数为
您最近一年使用:0次
2019-11-03更新
|
350次组卷
|
2卷引用:2019年广东省肇庆市一模理综化学试题
2018·河南郑州·三模
名校
解题方法
7 . CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO 等杂质)为原料制备CoCO3的一种工艺流程如下:

下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol·L-1计算):
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________ 。
(2)“除铝”过程中需要调节溶液pH 的范围为______________ ,形成沉渣时发生反应的离子方程式为_____________________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________ ;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)  ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________ 。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________ 。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴氧化物的化学式为____________________ 。

下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol·L-1计算):
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式
(2)“除铝”过程中需要调节溶液pH 的范围为
(3)在实验室里,萃取操作用到的玻璃仪器主要有
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴氧化物的化学式为
您最近一年使用:0次
2018-05-16更新
|
545次组卷
|
4卷引用:2019年广东省肇庆市高考化学二模试卷化学试题
(已下线)2019年广东省肇庆市高考化学二模试卷化学试题【全国市级联考】河南省郑州市2018届高三下学期第三次模拟考试理综化学试题(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题
名校
解题方法
8 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
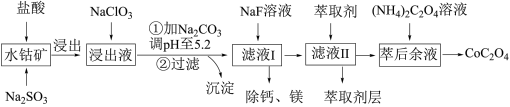
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
5卷引用:2016届广东省肇庆市高三上学期期末质检理综化学试卷
解题方法
9 . 锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:

(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是_________________ 。
(2)净化1是为了将Mn2+转化为MnO2而除去,试写出该反应的离子方程式__________ 。
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如图。pH值中等时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是________________________ 。

(4)滤渣3的主要成分为___________ (填化学式)。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3•2Zn(OH)2•H2O,写出碳化过程生成“前驱体”的化学方程式___________________ ;碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,二是_______________________ 。

(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是
(2)净化1是为了将Mn2+转化为MnO2而除去,试写出该反应的离子方程式
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如图。pH值中等时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是

(4)滤渣3的主要成分为
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3•2Zn(OH)2•H2O,写出碳化过程生成“前驱体”的化学方程式
您最近一年使用:0次
2016-12-09更新
|
448次组卷
|
3卷引用:2015届广东省肇庆一中等五校高三联考(三模)理综化学试卷
解题方法
10 . 利用某地的闪锌矿(主要成分为ZnS,其杂质主要为铁、铜元素等)冶炼纯锌的传统工艺如下:

注:锌、铁、铜的沸点依次为1180K、2862K、1800K
(1)高温焙烧时,若氧气足量,则ZnS发生的化学反应方程式为______________________ 。
(2)方案1由锌熔体获得粗锌的的操作为____ (填:“蒸馏”、“分馏”或“干馏”)。
(3)工业生产中方案2中固相2的成分为_________ ,液相1所含金属阳离子为:_________ 。
(4)方案2中从液相1获取粗锌的过程中可用加入单质________ 除掉其他杂质;对比两种方案,方案2的优点是____________________ 。
(5)方案2的系列操作产生的废液可以制取绿矾。硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示:
从上表数据可以得出的结论是:①__________________ ;②____________________________ 。

注:锌、铁、铜的沸点依次为1180K、2862K、1800K
(1)高温焙烧时,若氧气足量,则ZnS发生的化学反应方程式为
(2)方案1由锌熔体获得粗锌的的操作为
(3)工业生产中方案2中固相2的成分为
(4)方案2中从液相1获取粗锌的过程中可用加入单质
(5)方案2的系列操作产生的废液可以制取绿矾。硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 70 | 80 | 90 |
| 溶解度 | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 33.5 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||
您最近一年使用:0次



