A.磁性氧化铁溶于足量稀硝酸: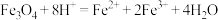 |
B.NaClO溶液与HI溶液反应: |
C. 溶液和过量 溶液和过量 溶液混合: 溶液混合: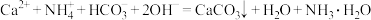 |
D.明矾溶液中滴入 溶液使 溶液使 恰好完全沉淀: 恰好完全沉淀: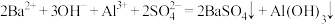 |
 )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: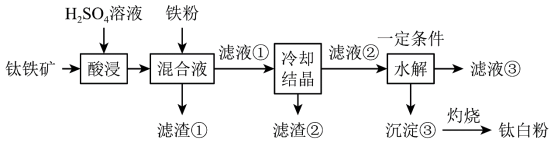
 形式存在;
形式存在;②强电解质
 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;③
 不溶于水和稀酸。
不溶于水和稀酸。(1)要提高酸浸速率,可采取的措施是
(2)滤渣①中除铁粉外,还可能含有的成分是
(3)酸浸过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(4)加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。①在其他条件不变的情况下,体系中Fe(III)[指
 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以 沉淀完全)形式存在。
沉淀完全)形式存在。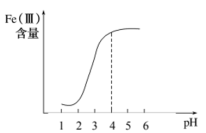
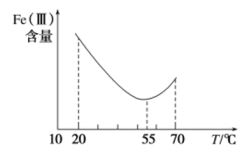
3 . Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但是 固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用
固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用 进行标定。但是由于
进行标定。但是由于 与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用
与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用 与过量的KI反应,定量生成
与过量的KI反应,定量生成 ,再用Na2S2O3滴定
,再用Na2S2O3滴定 ,发生反应的化学方程式为:
,发生反应的化学方程式为: 、
、 。我们将这种
。我们将这种 与
与 联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知: 与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
(1)
 标准溶液的配制:
标准溶液的配制:①配制480 mL 0.1 mol/L的 标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
②将下述实验步骤A到F按实验过程先后次序排列
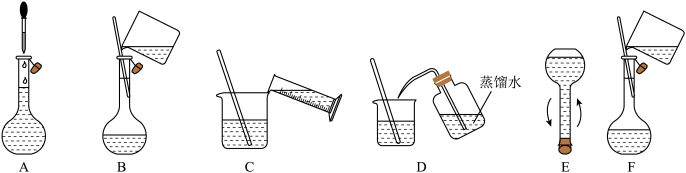
(2)
 标准溶液的标定:取20.00 mL 0.017 mol/L
标准溶液的标定:取20.00 mL 0.017 mol/L  溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用
溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用 溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算
溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算 标准溶液的浓度。
标准溶液的浓度。①用 溶液。
溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是
③如何判定滴定结束?
④列式并计算 标准溶液的浓度。
标准溶液的浓度。
| KI溶液 |
|
|
20.00 mL 0.017 mol/L | 10 mL 100 g/L | 20.35 | |
20.45 | |||
20.40 | |||
21.20 |
(3)借鉴(2)的方法,用碘量法测量
 溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L
溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L  溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的
溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的 溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用
溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用 溶液继续滴定至终点。
溶液继续滴定至终点。①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?
②写出 溶液与KI反应的离子方程式
溶液与KI反应的离子方程式
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中
 的物质的量浓度。
的物质的量浓度。提出问题: 与
与 是可逆反应,
是可逆反应, 的存在是否会影响滴定?
的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出 与
与 反应的离子方程式:
反应的离子方程式:
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用 溶液进行标定,发现消耗的
溶液进行标定,发现消耗的 溶液体积相同。
溶液体积相同。
实验小结: 是否会影响滴定:
是否会影响滴定:
 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。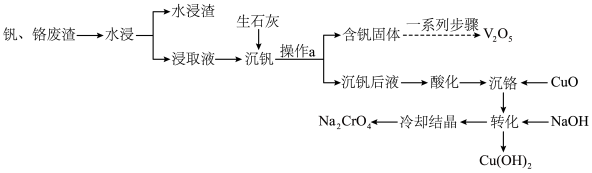
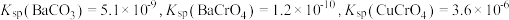 。
。回答下列问题:
(1)基态铬原子价电子轨道表示式为
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有
(3)“沉钒”的含钒产物为钒酸钙
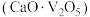 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是(4)“沉铬”时,铬转化为
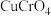 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为(5)向“沉钒后液”中加入足量
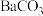 ,可将其中的铬转化为
,可将其中的铬转化为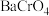 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为 。
。(6)复合材料氧铬酸钙的立方晶胞如下图所示。
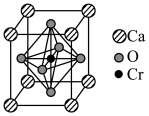
②已知该晶体的密度为
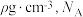 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与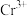 之间的最短距离为
之间的最短距离为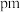 (列出计算式即可)。
(列出计算式即可)。
A.向NaHSO4中滴加少量Ba(HCO3)2溶液: |
B.向有AgCl沉淀的溶液中滴加氨水,沉淀消失: |
C.向FeI2溶液中通入一定量氯气,测得有50%的Fe2+被氧化: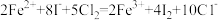 |
D.NaHCO3的水解: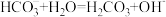 |

A.该过程中可得到化工产品 |
B.该工艺流程是除去煤燃烧时产生的 |
| C.该过程中化合价发生改变的元素为Fe和S |
D.图中涉及的反应之一为 |
 ,设杂质均不参与反应)为原料生产硫酸的简要流程图如图(图中标注的热量表示各阶段1mol含硫物质完全反应时放出的热量,忽略
,设杂质均不参与反应)为原料生产硫酸的简要流程图如图(图中标注的热量表示各阶段1mol含硫物质完全反应时放出的热量,忽略 催化氧化的可逆性):
催化氧化的可逆性):
下列说法正确的是
A.黄铁矿“煅烧”时反应的化学方程式为 |
B.依据上述流程,当最终生成 时,共转移7.5mol电子 时,共转移7.5mol电子 |
C.生成 ,上述流程放出的总热量为634.2kJ ,上述流程放出的总热量为634.2kJ |
D.上述流程中,当有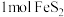 完全转化为 完全转化为 时,反应中共消耗了 时,反应中共消耗了 |
(1)生铁中含有一种铁碳化合物X,实验室测定该化合物X组成的实验如下,最终得到的固体2是
 。
。
①已知固体Ⅰ有磁性,将固体Ⅰ溶于过量盐酸后,溶液中含有的大量正离子是
②X的化学式可表示为
(2)某溶液中有
 、
、 、
、 、
、 四种正离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是_______。(填选项)
四种正离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是_______。(填选项)A. | B. | C. | D. |
 可得到此颜料。写出在空气中煅烧
可得到此颜料。写出在空气中煅烧 的化学方程式
的化学方程式(4)向含有
 和
和 的混合溶液中逐渐加入铁粉至过量,溶液中金属正离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。(本题要求书写解题过程)
的混合溶液中逐渐加入铁粉至过量,溶液中金属正离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。(本题要求书写解题过程)
①a表示的是
②

③向P点溶液中加入铜粉,发生反应的离子方程式为
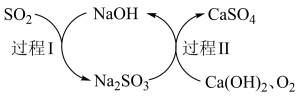
A.过程Ⅰ中, 表现出酸性氧化物的性质 表现出酸性氧化物的性质 |
B.过程Ⅱ中,1mol  可氧化2mol 可氧化2mol  |
C.双碱法脱硫过程中, 起的是催化作用 起的是催化作用 |
D.总反应为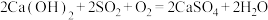 |
 )可用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO,含少量NiO、CuO、FeO和
)可用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO,含少量NiO、CuO、FeO和 等)为原料制备无水氯化钴的流程如下:
等)为原料制备无水氯化钴的流程如下: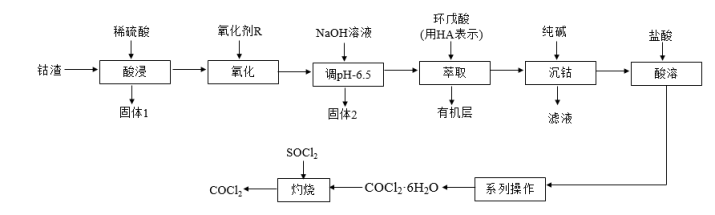
已知:几种金属离子沉淀的pH如下表所示:
| 金属离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Co2+ | 7.6 | 9.2 |
| Cu2+ | 4.4 | 6.4 |
| Ni2+ | 6.8 | 8.4 |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.5 |
请回答下列问题:
(1)“酸浸”时,用稀硝酸代替稀硫酸,缺点是
(2)“氧化剂R”的作用是
(3)“固体2”的主要成分是
(4)M代表被萃取的离子,萃取过程简化为
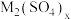 (水层)+2xHA (有机层)
(水层)+2xHA (有机层) 2MAx(有机层)+xH2SO4 (水层)。在萃取过程中加入适量氨水,其作用是
2MAx(有机层)+xH2SO4 (水层)。在萃取过程中加入适量氨水,其作用是(5)室温下,“沉钴”时,当溶液中
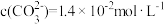 时,
时,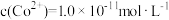 ,
,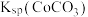 =
=(6)
 与水反应生成SO2和HCl。“灼烧”时发生反应的化学方程式为
与水反应生成SO2和HCl。“灼烧”时发生反应的化学方程式为(7)测定CoCl2产品纯度:准确称取mg CoCl2产品溶于蒸馏水配制成250mL溶液,量取25.00mL所配制溶液于锥形瓶中,滴几滴K2CrO4溶液,用cmol/L的AgNO3溶液滴定至终点,消耗AgNO3溶液的体积为xmL。该产品纯度为





