名校
1 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。

(1)A、B、C三种物质中,属于电解质的是_______ (填化学式)。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)C可与HCl反应生成A,写出该反应的化学方程式_______ 。
(4)已知D可用于实验室制 ,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式_______ 。

(1)A、B、C三种物质中,属于电解质的是
(2)写出
 的电离方程式
的电离方程式(3)C可与HCl反应生成A,写出该反应的化学方程式
(4)已知D可用于实验室制
 ,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
,其焰色试验为紫色。D可以用A与某强碱溶液在加热下反应制得,除生成D外,还生成一种无氧酸盐和水,写出该反应的化学方程式
您最近一年使用:0次
名校
2 . 光伏材料是指能将太阳能直接转换成电能的材料,又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)Ga与B同主族,基态Ga原子价电子排布式为___________ 。
(2)Ga失去电子的逐级电离能(单位:kJ⋅mol⁻¹)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为___________ 和+3。
(3)下列事实能说明硫的非金属性比硒强的是___________ (填字母)。
A.溶解度: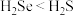
B.沸点: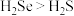
C.酸性: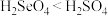
(4)Ga、P、S的电负性从大到小的顺序为___________ 。
(5)与Al元素在元素周期表中处于对角线的铍,在性质上具有相似性,写出铍的氧化物与氢氧化钠溶液反应生成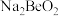 的离子方程式
的离子方程式___________ 。
(6)工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30 min可制得疏松的灰色粉末状GaN,同时得到一种单质,写出该反应的化学方程式___________ 。
(1)Ga与B同主族,基态Ga原子价电子排布式为
(2)Ga失去电子的逐级电离能(单位:kJ⋅mol⁻¹)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为
(3)下列事实能说明硫的非金属性比硒强的是
A.溶解度:
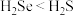
B.沸点:
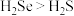
C.酸性:
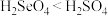
(4)Ga、P、S的电负性从大到小的顺序为
(5)与Al元素在元素周期表中处于对角线的铍,在性质上具有相似性,写出铍的氧化物与氢氧化钠溶液反应生成
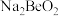 的离子方程式
的离子方程式(6)工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30 min可制得疏松的灰色粉末状GaN,同时得到一种单质,写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
3 . CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成分为CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
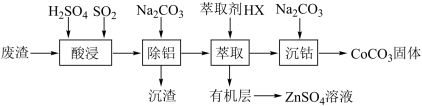
已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“酸浸”时加快溶解的方法有___________ (写出一种)。
(2)写出“酸浸”时发生氧化还原反应的化学方程式___________ 。
(3)“除铝”过程中需要调节溶液pH的范围为___________ ,形成沉渣时发生反应的离子方程式为___________ 。
(4)“沉钴”后经过滤、洗涤、干燥可得CoCO3固体,其中洗涤沉淀的方法是___________ 。
(5)当Co2+沉淀完全时[c(Co2+)≤1×10-5mol·L-1],溶液中c(CO )至少应大于
)至少应大于___________ 。
(6)在空气中煅烧CoCO3生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴的氧化物的化学式为___________ 。

已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(1)“酸浸”时加快溶解的方法有
(2)写出“酸浸”时发生氧化还原反应的化学方程式
(3)“除铝”过程中需要调节溶液pH的范围为
(4)“沉钴”后经过滤、洗涤、干燥可得CoCO3固体,其中洗涤沉淀的方法是
(5)当Co2+沉淀完全时[c(Co2+)≤1×10-5mol·L-1],溶液中c(CO
 )至少应大于
)至少应大于(6)在空气中煅烧CoCO3生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴的氧化物的化学式为
您最近一年使用:0次
名校
解题方法
4 . 请按要求书写化学用语
(1)实验室制取氯气离子方程式:___________ 。
(2)工业制漂白粉的化学方程式:___________ 。
(3)碳酸氢钠溶液中滴加少量澄清石灰水的离子方程式:___________ 。
(4)2.3克钠放在100克水中放出aKJ热量的热化学方程式:___________ 。
(5)用NaClO和Fe2(SO4)3在碱性条件下制备高铁酸钠(Na2FeO4)的离子方程式___________ 。
(1)实验室制取氯气离子方程式:
(2)工业制漂白粉的化学方程式:
(3)碳酸氢钠溶液中滴加少量澄清石灰水的离子方程式:
(4)2.3克钠放在100克水中放出aKJ热量的热化学方程式:
(5)用NaClO和Fe2(SO4)3在碱性条件下制备高铁酸钠(Na2FeO4)的离子方程式
您最近一年使用:0次
5 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态,可以对物质的性质进行解释和预测。
Ⅰ、有三种物质: 、
、 、
、
(1)其中氧元素的化合价均为___________ 价。
(2)从氧化剂和还原剂的角度,分析反应中的 作用。请完成下表内容。
作用。请完成下表内容。
(3)由 、
、 的名称可推知
的名称可推知 的名称为
的名称为___________ 。
(4)已知 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式___________ ,由此可推测 也可做供氧剂。
也可做供氧剂。
II、亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。
(5)误食 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。
(6)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过150毫克,以此计算,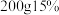 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠___________ 千克。
(7)亚硝酸钠在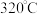 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目___________ 。

Ⅰ、有三种物质:
 、
、 、
、
(1)其中氧元素的化合价均为
(2)从氧化剂和还原剂的角度,分析反应中的
 作用。请完成下表内容。
作用。请完成下表内容。| 序号 | 化学反应方程式 | 作用 |
| ① |  | |
| ② |  | |
| ③ | 既作氧化剂,又作还原剂 |
(3)由
 、
、 的名称可推知
的名称可推知 的名称为
的名称为(4)已知
 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式 也可做供氧剂。
也可做供氧剂。II、亚硝酸钠
 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。(5)误食
 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。A. 被还原 被还原 | B.维生素 具有还原性 具有还原性 |
C.还原性:维生素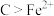 | D. 是还原剂 是还原剂 |
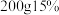 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠(7)亚硝酸钠在
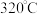 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
您最近一年使用:0次
2022-10-23更新
|
512次组卷
|
2卷引用:广东省兴宁市齐昌中学2022-2023学年高一上学期期中考试化学试题
名校
6 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)提纯白磷样品(含惰性杂质)的流程如图1所示。过程I中,被还原的元素是_______ (填元素符号),过程III的化学方程式为_______ 。

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是一种十分具有商业潜力的电极材料,其制备流程如图2:
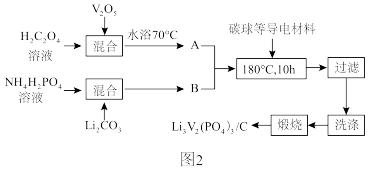
①A的主要成分为V2(C2O4)3,H2C2O4溶液与V2O5反应生成A的化学方程式为_______ 。
②流程中加入碳球的作用是_______ 。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。提纯工业级Li2CO3的实验方案是:将工业级Li2CO3与水混合,_______ ,得到LiHCO3溶液;控温加热使LiHCO3分解形成Li2CO3沉淀,再过滤、洗涤、干燥,得到Li2CO3纯品。“洗涤”时用乙醇而不用水的目的是_______ 。
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6。电池放电时,正极的电极反应式为_______ 。
(1)提纯白磷样品(含惰性杂质)的流程如图1所示。过程I中,被还原的元素是

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是一种十分具有商业潜力的电极材料,其制备流程如图2:

①A的主要成分为V2(C2O4)3,H2C2O4溶液与V2O5反应生成A的化学方程式为
②流程中加入碳球的作用是
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。提纯工业级Li2CO3的实验方案是:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6。电池放电时,正极的电极反应式为
您最近一年使用:0次
2022-10-21更新
|
236次组卷
|
2卷引用:广东省梅州市丰顺县丰顺中学2022-2023学年高三上学期1月期末考试化学试题
7 . 下列相关说法正确的是
| 化学反应方程式 | 相关说法 | |
| A | 双线桥: | 双线桥标注规范正确 |
| B | 2Fe3++Cu=2Fe2++Cu2+ | 由此可知氧化性:Cu>Fe2+ |
| C | 4CuO=2Cu2O+O2↑ | 该反应中每生成1个O2,转移2个电子 |
| D | _______ClO-+_______Fe3++_______OH-=_______ +_______Cl-+_______H2O +_______Cl-+_______H2O | 化学计量数依次为:3,2,10,2,3,5 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-07更新
|
268次组卷
|
7卷引用:广东省大埔县虎山中学2022-2023学年高一上学期(11月)期中考试化学试题
名校
8 . Cl2在70℃的NaOH水溶液中自身发生氧化还原反应,完全反应后,测得溶液中有NaCl、NaClO、NaClO3,其中NaClO与NaClO3的个数之比为4︰1,则溶液中NaCl与NaClO的个数之比为
| A.1︰1 | B.5︰4 | C.9︰4 | D.11︰2 |
您最近一年使用:0次
2022-09-11更新
|
1144次组卷
|
7卷引用:广东省大埔县虎山中学2022-2023学年高一上学期(11月)期中考试化学试题
名校
9 . 中国科学家以 和
和 为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是
为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是
 和
和 为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是
为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是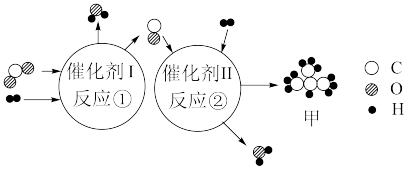
| A.反应①反应前后各元素化合价不变 |
B.反应①的化学方程式为 |
C.在反应②中,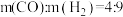 |
| D.在甲物质中,氢元素的质量分数约为17.24% |
您最近一年使用:0次
2022-09-01更新
|
225次组卷
|
3卷引用:广东省大埔县虎山中学2022-2023学年高一上学期(11月)期中考试化学试题
10 . 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍和硫酸铜晶体的新工艺。工艺流程如图所示:
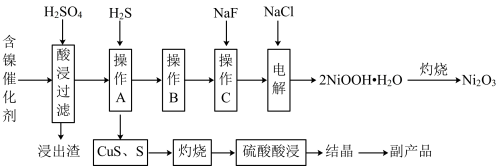
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
请回答下列问题:
(1)加快酸浸速率的常用措施有___________ (任写一条即可)。
(2)“浸出渣”主要成分为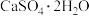 和
和___________ 两种物质。
(3)“操作B”的过程是:先在40~50℃温度下加入 ,其作用是
,其作用是___________ (用离子方程式表示);再调pH至___________ (填pH范围),操作B可除去溶液中的___________ 元素(填元素名称)。
(4)在碱性条件下,电解产生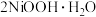 的原理是:
的原理是: 在阳极被氧化为
在阳极被氧化为 ,
, 再被
再被 氧化产生
氧化产生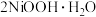 沉淀。请写出
沉淀。请写出 被
被 氧化得到
氧化得到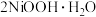 沉淀的离子方程式
沉淀的离子方程式___________ 。
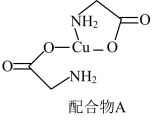
(5)配合物A常用于医药、电镀等方面,其结构如图所示。向硫酸铜溶液中滴入氨基乙酸钠(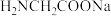 )即可得到它,配合物A中的配位原子的电负性由大到小的顺序是
)即可得到它,配合物A中的配位原子的电负性由大到小的顺序是___________ 。

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
请回答下列问题:
(1)加快酸浸速率的常用措施有
(2)“浸出渣”主要成分为
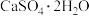 和
和(3)“操作B”的过程是:先在40~50℃温度下加入
 ,其作用是
,其作用是(4)在碱性条件下,电解产生
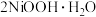 的原理是:
的原理是: 在阳极被氧化为
在阳极被氧化为 ,
, 再被
再被 氧化产生
氧化产生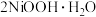 沉淀。请写出
沉淀。请写出 被
被 氧化得到
氧化得到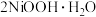 沉淀的离子方程式
沉淀的离子方程式(5)配合物A常用于医药、电镀等方面,其结构如图所示。向硫酸铜溶液中滴入氨基乙酸钠(
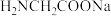 )即可得到它,配合物A中的配位原子的电负性由大到小的顺序是
)即可得到它,配合物A中的配位原子的电负性由大到小的顺序是
您最近一年使用:0次
2022-08-25更新
|
415次组卷
|
2卷引用:广东省梅州市梅江区梅州中学2022-2023学年高三上学期8月阶段性考试化学试题



