名校
解题方法
1 . 铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为 、
、 ,还有少量
,还有少量 、
、 、
、 )制备
)制备 的流程如图:
的流程如图:

回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是___________ 。
(2)向废铅膏粉中加入 溶液可将
溶液可将 转化为
转化为 ,并除去
,并除去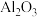 ,写出除去
,写出除去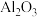 的反应的离子方程式
的反应的离子方程式___________ 。
(3)溶液I中主要含有的阴离子有 、
、___________ 。
(4)加入 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为 。
。 转化为
转化为 的化学方程式是
的化学方程式是___________ 。
(5)为使 完全沉淀并获得纯净的
完全沉淀并获得纯净的 ,需向溶液Ⅱ中分两次加入
,需向溶液Ⅱ中分两次加入 溶液。第一次加入的目的是
溶液。第一次加入的目的是___________ ,过滤后,第二次加入 溶液调节溶液的
溶液调节溶液的 至少为
至少为___________ 。(已知:25℃, ,
, ,离子浓度
,离子浓度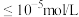 可视为沉淀完全)
可视为沉淀完全)
 、
、 ,还有少量
,还有少量 、
、 、
、 )制备
)制备 的流程如图:
的流程如图:
回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是
(2)向废铅膏粉中加入
 溶液可将
溶液可将 转化为
转化为 ,并除去
,并除去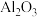 ,写出除去
,写出除去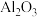 的反应的离子方程式
的反应的离子方程式(3)溶液I中主要含有的阴离子有
 、
、(4)加入
 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为 。
。 转化为
转化为 的化学方程式是
的化学方程式是(5)为使
 完全沉淀并获得纯净的
完全沉淀并获得纯净的 ,需向溶液Ⅱ中分两次加入
,需向溶液Ⅱ中分两次加入 溶液。第一次加入的目的是
溶液。第一次加入的目的是 溶液调节溶液的
溶液调节溶液的 至少为
至少为 ,
, ,离子浓度
,离子浓度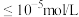 可视为沉淀完全)
可视为沉淀完全)
您最近一年使用:0次
2022-08-15更新
|
772次组卷
|
3卷引用:广东省梅州市大埔县虎山中学2022-2023学年高三上学期11月月考化学试题
广东省梅州市大埔县虎山中学2022-2023学年高三上学期11月月考化学试题广东省广州市省实、执信、广雅、六中四校2022-2023学年高三8月联考化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)
名校
2 . 无水氯化钴(CoCl2)用作彩色水泥的添加剂、催化剂、饲料等,以钴渣(主要成分是CoO含少量NiO、CuO、FeO和SiO2等)为原料制备无水氯化钴的工艺流程如图:
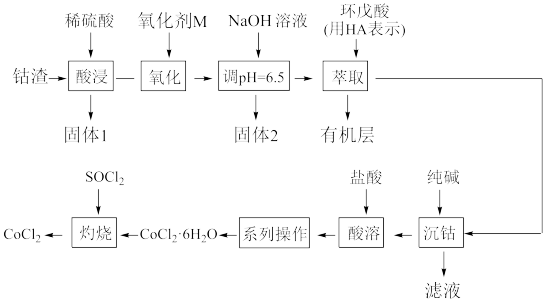
已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题:
(1)固体1的主要成分是____ (填化学式)。
(2)从绿色化学角度考虑选择试剂M为H2O2,其作用是____ (用离子方程式表示)。“调pH=6.5”除去的固体2的成分是____ (填化学式)。
(3)“萃取”目的是除去____ (填离子符号)。
(4)“系列操作”的实验操作依次为缓缓加热,浓缩至溶液表面出现结晶薄膜为止、____ 、过滤、洗涤、干燥,即得产品。
(5)“灼烧”过程生成两种溶于水呈酸性的气体,请写出相应的化学方程式____ 。
(6)测定CoCl2产品纯度:准确称取mg产品溶于蒸馏水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴K2CrO4溶液作指示剂,用cmol·L-1AgNO3滴定至终点,消耗滴定液体积为xmL。该产品纯度为____ (用含m、c和x的代数式表示)。

已知几种金属氢氧化物沉淀的pH如表所示:
| 金属离子 | Co2+ | Cu2+ | Ni2+ | Fe3+ | Fe2+ |
| 开始沉淀时pH | 7.6 | 4.4 | 6.8 | 1.9 | 7.5 |
| 完全沉淀时pH | 9.2 | 6.4 | 8.4 | 3.2 | 9.5 |
请回答下列问题:
(1)固体1的主要成分是
(2)从绿色化学角度考虑选择试剂M为H2O2,其作用是
(3)“萃取”目的是除去
(4)“系列操作”的实验操作依次为缓缓加热,浓缩至溶液表面出现结晶薄膜为止、
(5)“灼烧”过程生成两种溶于水呈酸性的气体,请写出相应的化学方程式
(6)测定CoCl2产品纯度:准确称取mg产品溶于蒸馏水配制成250mL溶液,量取25.0mL于锥形瓶中,加入几滴K2CrO4溶液作指示剂,用cmol·L-1AgNO3滴定至终点,消耗滴定液体积为xmL。该产品纯度为
您最近一年使用:0次
3 . 已知氯化亚锡分子式为SnCl2,常温时水中溶解度为2.7g,从水溶液中析出时形成SnCl2•2H2O晶体。锡的另一种盐SnCl4常温时水中溶解度为128g。某锡花中(主要成分为锡)含有杂质镁、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如图:

(1)①“溶浸”时提高溶浸率的措施有____ (任写一个)。
②“溶浸”后的锡主要以SnCl4的形式存在于混合液中。写出Sn与SnCl4反应的化学方程____ 。
③“溶浸”时,加热反应器使反应液温度升高至60℃,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80~90℃之间,不宜过高。温度不宜过高的原因是____ 。“操作a”的名称是____ 。
(2)①基态Sn原子价层电子的电子排布式为____ ,在元素周期表中属于____ 区。
②铜锡合金晶体有多种结构,其中一种晶体的晶胞为立方晶胞(如图),则该晶体中铜、锡原子个数比为____ ,若阿伏加德罗常数为NA,晶胞参数为apm,则合金晶体的密度为____ g•cm-3(用含a、NA的式子表示,不必化简)。


(1)①“溶浸”时提高溶浸率的措施有
②“溶浸”后的锡主要以SnCl4的形式存在于混合液中。写出Sn与SnCl4反应的化学方程
③“溶浸”时,加热反应器使反应液温度升高至60℃,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80~90℃之间,不宜过高。温度不宜过高的原因是
(2)①基态Sn原子价层电子的电子排布式为
②铜锡合金晶体有多种结构,其中一种晶体的晶胞为立方晶胞(如图),则该晶体中铜、锡原子个数比为

您最近一年使用:0次
名校
4 . I.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如下,请回答下列问题
(1)实验①②研究的是_______ 对化学反应速率的影响,V1=_______ 。
(2)实验①③研究的是_______ 对化学反应速率的影响,V2=_______ 。
(3)t1、t2、t3由大到小的顺序是_______ 。
II.氮化钙(Ca3N2)有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。Ca3N2部分理化性质如下表:
工业上利用单质钙在氮气流中,控制温度450℃,可制得氮化钙。实验室模拟工业制备氮化钙,并对氮化钙纯度进行测定,实验方案如下:
Ca3N2制备:

(4)A装置中盛放(NH4)2SO4溶液的仪器名称为_______ 。
(5)A处产生N2,请写出A中反应的化学方程式_______ 。
(6)装置的连接顺序为A→_______ (注:以上所有装置都能用到)。
(7)实验开始时,先启动A处反应,一段时间后再点燃B处酒精灯,其原因是_______ 。
Ca3N2纯度测定:
称取氮化钙样品2.4g,按下图所示装置进行实验,发现B装置增重0.51g。

(8)该样品中氮化钙的质量分数为_______ 。
| 实验序号 | 反应温度 | 加入0.1mol/L Na2S2O3溶液的体积 | 加入0.1mol/L H2SO4溶液的体积 | 加入水的体积 | 出现浑浊的时间 |
| ℃ | mL | mL | mL | s | |
| ① | 20 | 2 | 2 | 0 | t1 |
| ② | 40 | 2 | V1 | 0 | t2 |
| ③ | 20 | 1 | 2 | V2 | t3 |
(2)实验①③研究的是
(3)t1、t2、t3由大到小的顺序是
II.氮化钙(Ca3N2)有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、新型陶瓷工业等领域。Ca3N2部分理化性质如下表:
| 性质 | 颜色、状态 | 熔点 | 特性 |
| 具体描述 | 常温下为棕色固体 | 1195 | 空气中会被氧化,遇水强烈水解,产生刺激性气味气体 |
Ca3N2制备:

(4)A装置中盛放(NH4)2SO4溶液的仪器名称为
(5)A处产生N2,请写出A中反应的化学方程式
(6)装置的连接顺序为A→
(7)实验开始时,先启动A处反应,一段时间后再点燃B处酒精灯,其原因是
Ca3N2纯度测定:
称取氮化钙样品2.4g,按下图所示装置进行实验,发现B装置增重0.51g。

(8)该样品中氮化钙的质量分数为
您最近一年使用:0次
名校
5 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。

请回答下列问题:
(1)LiCoO2中Co元素的化合价为_______ 。
(2)将废旧电池初步处理为粉末的目的是_______ 。
(3)请写出碱“浸液”过程中的化学方程式_______ 。
(4)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+。请写出该反应的离子方程式:_______ ,过滤后所得滤渣的主要成分为_______ (写化学式)。
(5)已知Fe3+能与 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+,该过程中
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+,该过程中_______ (填“有”或“没有”)发生元素化合价的变化;从FeCl3溶液中得到FeCl3·6H2O晶体的操作是:往溶液中加入适量盐酸后,蒸发浓缩、冷却结晶、_______ 、洗涤、干燥。
(6)检验滤液C中含有Na+的实验方法为_______ 。

请回答下列问题:
(1)LiCoO2中Co元素的化合价为
(2)将废旧电池初步处理为粉末的目的是
(3)请写出碱“浸液”过程中的化学方程式
(4)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+。请写出该反应的离子方程式:
(5)已知Fe3+能与
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+,该过程中
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+,该过程中(6)检验滤液C中含有Na+的实验方法为
您最近一年使用:0次
名校
6 . NH3是一种重要的化工原料,在半导体光催化的作用下,N2分子被光催化材料捕获进而实现N2→NH3的转化(过程如图)。下列说法错误的是


| A.该反应中,H2O被还原 |
| B.该反应属于氮的固定 |
| C.反应过程中包含非极性键的断裂和生成 |
D.总反应方程式为2N2+6H2O 4NH3+3O2 4NH3+3O2 |
您最近一年使用:0次
2022-05-04更新
|
214次组卷
|
3卷引用:广东省梅州市大埔县虎山中学2021-2022学年高一下学期第二次段考化学试题
名校
7 . 某实验小组同利用某工业废弃矿石(主要成分为Cu2S和Fe2O3,其他成分不参与反应)制备绿矾(FeSO4·7H2O)和胆矾(CuSO4·5H2O),其工艺流程如图所示:
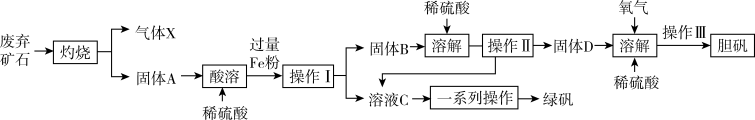
(1)“灼烧”时Cu2S转化为Cu,该反应中每生成6.4g的Cu,转移电子的物质的量为_______ 。
(2)“酸溶”过程中,红色固体A被溶解的离子方程式为_______ 。
(3)为检验溶液C中不含有Fe3+,而只含有Fe2+,应进行的实验操作和现象为_______ 。
(4)固体D、氧气和稀硫酸反应的离子方程式为_______ 。
(5)若称取12.0g废弃矿石经过上述流程最终得到2.50g胆矾,则废弃矿石中铜元素的含量(质量分数)为_______ %。(假设过程中没有铜元素损失,计算结果保留三位有效数字)
(6)加热FeSO4固体可发生分解反应,为探究分解产物,将FeSO4固体放在图所示的装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
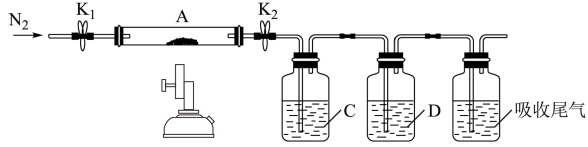
①C、D中的溶液依次为_______ (填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓硫酸
②写出FeSO4固体高温分解反应的化学方程式_______ 。

(1)“灼烧”时Cu2S转化为Cu,该反应中每生成6.4g的Cu,转移电子的物质的量为
(2)“酸溶”过程中,红色固体A被溶解的离子方程式为
(3)为检验溶液C中不含有Fe3+,而只含有Fe2+,应进行的实验操作和现象为
(4)固体D、氧气和稀硫酸反应的离子方程式为
(5)若称取12.0g废弃矿石经过上述流程最终得到2.50g胆矾,则废弃矿石中铜元素的含量(质量分数)为
(6)加热FeSO4固体可发生分解反应,为探究分解产物,将FeSO4固体放在图所示的装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓硫酸
②写出FeSO4固体高温分解反应的化学方程式
您最近一年使用:0次
2022-04-24更新
|
300次组卷
|
2卷引用:广东省梅州市兴宁市沐彬中学2021-2022学年高一下学期第二次月考化学试题
名校
8 . 已知草酸晶体(H2C2O4·aH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应,现用氧化还原滴定法测定草酸晶体的结晶水分子数a,步骤如下:
①准确称取该草酸晶体3.150 0 g,将其配制成250.00 mL待测草酸溶液;
②用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量的酸酸化;
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,四次滴定结果如下:
已知:H2C2O4的相对分子质量为90,回答下列问题:
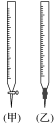
(1)①滴定时,将KMnO4标准液装在如下图中的_______ (填“甲”或“乙”)滴定管中。
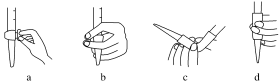
②排除碱式滴定管中气泡的方法应采用如下图所示操作中的_______ ,(填a、b、c或d)然后小心操作使尖嘴部分充满碱液。
(2)步骤②中加入适量的酸酸化,该酸可以是_______(填标号)。
(3)配平下列离子方程式:_______
_______MnO +_______H2C2O4+_______H+=_______Mn2++_______H2O+_______CO2↑
+_______H2C2O4+_______H+=_______Mn2++_______H2O+_______CO2↑
(4)到达滴定终点的标志是_______ 。
(5)根据上述数据计算a=_______ 。
(6)误差分析(填“偏高”“偏低”或“无影响”)
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则a值:_______ 。
②锥形瓶用蒸馏水洗净后,还残留有蒸馏水就装待测液,则a值:_______ 。
①准确称取该草酸晶体3.150 0 g,将其配制成250.00 mL待测草酸溶液;
②用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量的酸酸化;
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,四次滴定结果如下:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 待测溶液体积 (mL) | 25.00 | 25.00 | 25.00 | 25.00 |
| 消耗标准溶液体积(mL) | 9.99 | 10.01 | 10.50 | 10.00 |
(1)①滴定时,将KMnO4标准液装在如下图中的

②排除碱式滴定管中气泡的方法应采用如下图所示操作中的

(2)步骤②中加入适量的酸酸化,该酸可以是_______(填标号)。
| A.盐酸 | B.稀硫酸 | C.草酸 | D.浓硝酸 |
_______MnO
 +_______H2C2O4+_______H+=_______Mn2++_______H2O+_______CO2↑
+_______H2C2O4+_______H+=_______Mn2++_______H2O+_______CO2↑(4)到达滴定终点的标志是
(5)根据上述数据计算a=
(6)误差分析(填“偏高”“偏低”或“无影响”)
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则a值:
②锥形瓶用蒸馏水洗净后,还残留有蒸馏水就装待测液,则a值:
您最近一年使用:0次
名校
解题方法
9 . 已知Mn2O 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是
 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是| A.+2 | B.+4 | C.+3 | D.+6 |
您最近一年使用:0次
2022-02-28更新
|
851次组卷
|
36卷引用:广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题
广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题河南省安阳市第三十六中学2017-2018学年高一上学期期中考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用广东省2020年普通高中学业水平考试化学合格性考试模拟试题(七)陕西省汉中市龙岗学校2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】江西省九江一中2013-2014学年高一上学期期中考试化学试题广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题广东省中山纪念中学2019-2020学年高一上学期第二次段考化学试题山东省济宁市邹城兖矿一中2020-2021学年度高一9月月考化学试题吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】30湖南省岳阳市楚雄中学2020-2021学年高一上学期期中考试化学试题广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题北京市铁路第二中学2020-2021学年高一上学期期中考试化学试题(已下线)【南昌新东方】9. 2020 高一上 铁路一中 刘惠文 钟欣(已下线)【浙江新东方】双师 (55)宁夏青铜峡市高级中学2020-2021学年高一12月月考化学试题河北衡水市第十四中学2020-2021学年高一上学期三调考试化学试题天津市滨海新区2020-2021学年高一上学期期末考试化学试题河北省衡水市武邑武罗学校2020-2021学年高一上学期期中考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期第一次摸底考试化学试题河北省衡水市武强中学2020-2021学年高一上学期第一次月考化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期竞赛化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题四川省成都市第七中学2021-2022学年高一上学期期中考试化学试题四川省攀枝花市第十五中学校2021-2022学年高一上学期期中考试化学试题安徽省安庆市第十中学2021-2022学年高一上学期10月月考化学试题江苏省宿迁市泗阳县实验高级中学2021-2022学年高一上学期第二次调研测试化学试题浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 黑龙江省鹤岗市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学校2022-2023学年高一上学期第二次调研考试化学试题四川省仁寿县铧强中学2021-2022学年高一上学期半期考试化学试题云南省昆明市第八中学2020-2021学年高一上学期期中考试化学试题(已下线)专题七 氧化还原反应天津市宁河区2023-2024学年高一上学期期末考试化学试题
名校
10 . 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:(H2C2O4为弱酸)
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③滴定时用去l.0×l0-4mol/L的酸性KMnO4溶液的体积如图所示。

请回答下列问题:
(1)写出用酸性KMnO4溶液滴定H2C2O4的离子方程式___________ 。
(2)滴定时,将KMnO4溶液装在___________ (填“酸式”或“碱式”)滴定管中,滴定时共用去KMnO4溶液的体积为___________ 。
(3)判断滴定终点的方法是___________ 。
(4)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果___________ 。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果___________ 。
(5)计算:血液中含钙离子的浓度为___________ mol/L。
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③滴定时用去l.0×l0-4mol/L的酸性KMnO4溶液的体积如图所示。

请回答下列问题:
(1)写出用酸性KMnO4溶液滴定H2C2O4的离子方程式
(2)滴定时,将KMnO4溶液装在
(3)判断滴定终点的方法是
(4)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果
(5)计算:血液中含钙离子的浓度为
您最近一年使用:0次



