1 . 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。
(1)已知 能发生如下反应:
能发生如下反应: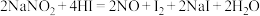 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:___________ 。
(2)
___________ (填“是”或“不是”)电解质,根据 中N的化合价是
中N的化合价是___________ ,推测 具有
具有___________ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(3)实验操作如表所示,请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
③通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_____________ 。
④写出实验3中发生反应的化学方程式:___________ 。
 )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。(1)已知
 能发生如下反应:
能发生如下反应: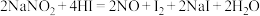 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:(2)

 中N的化合价是
中N的化合价是 具有
具有(3)实验操作如表所示,请完善表格中的实验现象和结论(已知
 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 | 结论 |
| 1 | 取 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有① 具有① |
| 2 | 取 溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为② 溶液,可观察到的实验现象为② |  具有还原性 具有还原性 |
| 3 |  固体与70%硫酸反应生成了NO和 固体与70%硫酸反应生成了NO和 两种气体 两种气体 |  具有氧化性和还原性 具有氧化性和还原性 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为④写出实验3中发生反应的化学方程式:
您最近一年使用:0次
2023-06-08更新
|
346次组卷
|
2卷引用:广东省梅州市五华县田家炳中学2022-2023学年高一上学期12月月考化学试题
名校
2 . 回答下列问题:
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是_______ (填化学式,下同); 被还原的元素是_______ ;氧化产物是_______ 。
②若有 96克 Cu 参与反应时,则生成的NO质量为_______ g。
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目_____ 。
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是_______ 。
②写出该反应的化学方程式_______ 。
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是
②若有 96克 Cu 参与反应时,则生成的NO质量为
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是
②写出该反应的化学方程式
您最近一年使用:0次
名校
3 . 现有下列10种物质:①铝,②纯醋酸,③CO2,④H2SO4,⑤NaOH,⑥硫酸铜溶液,⑦熔融的NaCl,⑧NaHSO4,⑨硝酸钾晶体,⑩乙醇。
(1)上述物质中属于非电解质的有_______ (填序号);①②⑥⑦⑨⑩这六种物质中能导电的有_______ (填序号)。
(2)向⑥中加入⑤发生的化学反应,属于_______ 反应(填反应类型)。
(3)⑧在水中的电离方程式为_______ 。
(4)生活中常用的“84”消毒液(主要成分是NaClO)与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体Cl2,写出该反应的离子方程式_______ 。
(1)上述物质中属于非电解质的有
(2)向⑥中加入⑤发生的化学反应,属于
(3)⑧在水中的电离方程式为
(4)生活中常用的“84”消毒液(主要成分是NaClO)与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体Cl2,写出该反应的离子方程式
您最近一年使用:0次
名校
4 .  可用于面粉的漂白和杀菌。已知:
可用于面粉的漂白和杀菌。已知: 为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。
为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。
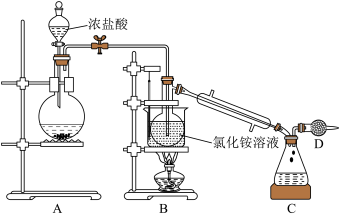
Ⅰ.实验室可用 和
和 溶液反应制取
溶液反应制取 ,所用装置如图:
,所用装置如图:
完成下列填空:
(1)三卤化氮( )的分子空间构型与
)的分子空间构型与 相似,热稳定性比
相似,热稳定性比 强的
强的 有
有_______ 。
(2)仪器D的作用是_______ 。
(3)向蒸馏烧瓶内的 溶液中通入过量
溶液中通入过量 ,B中反应的化学方程式为
,B中反应的化学方程式为_______ ,待反应至油状液体不再增加,关闭装置A、B间的止水夹,控制水浴加热的温度范围为_______ ,将产品 蒸出。
蒸出。
Ⅱ.待反应结束,为测定溶液中残留的的物质的量浓度,进行如下操作:
ⅰ.取蒸馏烧瓶中的反应液25.00mL,加入过量饱和 溶液充分反应后,再加入过量30%的NaOH溶液,微热;
溶液充分反应后,再加入过量30%的NaOH溶液,微热;
ⅱ.用15.00mL 的稀硫酸吸收产生的
的稀硫酸吸收产生的 ,得到溶液A;
,得到溶液A;
ⅲ.用 的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。
的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。
(4)滴定至终点时溶液中溶质仅有 和
和 ,用含V的代数式表示残留液中
,用含V的代数式表示残留液中 的物质的量浓度为
的物质的量浓度为_______  。
。
(5)为减小误差,滴定时最适宜的指示剂为_______(选填序号)。
 可用于面粉的漂白和杀菌。已知:
可用于面粉的漂白和杀菌。已知: 为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。
为黄色油状液体,熔点为-40℃,沸点为70℃,95℃以上易爆炸。Ⅰ.实验室可用
 和
和 溶液反应制取
溶液反应制取 ,所用装置如图:
,所用装置如图:
完成下列填空:
(1)三卤化氮(
 )的分子空间构型与
)的分子空间构型与 相似,热稳定性比
相似,热稳定性比 强的
强的 有
有(2)仪器D的作用是
(3)向蒸馏烧瓶内的
 溶液中通入过量
溶液中通入过量 ,B中反应的化学方程式为
,B中反应的化学方程式为 蒸出。
蒸出。Ⅱ.待反应结束,为测定溶液中残留的的物质的量浓度,进行如下操作:
ⅰ.取蒸馏烧瓶中的反应液25.00mL,加入过量饱和
 溶液充分反应后,再加入过量30%的NaOH溶液,微热;
溶液充分反应后,再加入过量30%的NaOH溶液,微热;ⅱ.用15.00mL
 的稀硫酸吸收产生的
的稀硫酸吸收产生的 ,得到溶液A;
,得到溶液A;ⅲ.用
 的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。
的NaOH标准液滴定溶液A至滴定终点,消耗VmL NaOH标准液。(4)滴定至终点时溶液中溶质仅有
 和
和 ,用含V的代数式表示残留液中
,用含V的代数式表示残留液中 的物质的量浓度为
的物质的量浓度为 。
。(5)为减小误差,滴定时最适宜的指示剂为_______(选填序号)。
| A.酚酞 | B.甲基橙 | C.石蕊 | D.淀粉溶液 |
您最近一年使用:0次
名校
解题方法
5 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(1)过程①进行的操作是_____ 、_____ 。
(2)检验Na2CO3溶液中的金属阳离子的方法是_____ 。
(3)上述流程中,加入NaOH后,发生反应的化学方程式为_____ 。
(4)用工业废渣吸收44.8LSO2(标准状况下),理论上可以生产_____ g的亚硫酸钠。
(5)Na2SO3具有还原性,露置在空气中容易变质产生Na2SO4,写出对应的化学反应方程式_____ 。

(1)过程①进行的操作是
(2)检验Na2CO3溶液中的金属阳离子的方法是
(3)上述流程中,加入NaOH后,发生反应的化学方程式为
(4)用工业废渣吸收44.8LSO2(标准状况下),理论上可以生产
(5)Na2SO3具有还原性,露置在空气中容易变质产生Na2SO4,写出对应的化学反应方程式
您最近一年使用:0次
6 . 某学生用0.1500mol/LNaOH溶液测定未知浓度的盐酸溶液,其操作可分为如下几步:
A.检查滴定管是否漏水
B.用蒸馏水洗净滴定管
C.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作2~3次
完成以下填空:
(1)滴定时边滴边摇动锥形瓶,眼睛应注意观察_______ 。
(2)滴定结果如表所示:
计算该盐酸的物质的量浓度为_______ (精确至0.0001)。
(3)下列操作会导致测定结果偏高的是_______。(填字母)
(4)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10-4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式_______ 。判断滴定终点是_______ 。
A.检查滴定管是否漏水
B.用蒸馏水洗净滴定管
C.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作2~3次
完成以下填空:
(1)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(2)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(3)下列操作会导致测定结果偏高的是_______。(填字母)
| A.碱式滴定管在装液前未用标准NaOH溶液润洗 |
| B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 |
| C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 |
| D.达到滴定终点时,仰视读数 |
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10-4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式
您最近一年使用:0次
名校
解题方法
7 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如图:
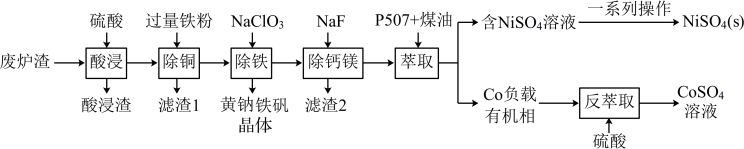
已知:i.酸浸液中的金属阳离子有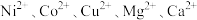 等。
等。
ii. 在水中的溶解度随温度升高而增大。
在水中的溶解度随温度升高而增大。
回答下列问题:
(1)提高“酸浸”速率的方法有___________ 。(任写一条)
(2)基态 原子的核外电子排布式为
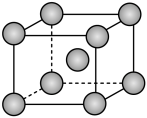
原子的核外电子排布式为___________ ;Fe的晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,若晶胞参数为anm,则Fe晶胞的密度为___________ 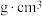 (用含NA和a的代数式表示)。
(用含NA和a的代数式表示)。
(3)黄钠铁矾的化学式为 ,“除铁”的离子方程式为
,“除铁”的离子方程式为___________ 。
(4)“除钙镁”时,随 降低,
降低, 用量急剧增加,原因是
用量急剧增加,原因是___________ (结合平衡理论解释), 和
和 沉淀完全时,溶液中
沉淀完全时,溶液中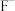 的浓度
的浓度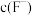 最小为
最小为___________  。(已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,
。(已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,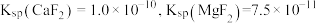 )
)
(5)获得 的“一系列操作”是
的“一系列操作”是___________ 、过滤、洗涤、干燥。

已知:i.酸浸液中的金属阳离子有
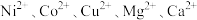 等。
等。ii.
 在水中的溶解度随温度升高而增大。
在水中的溶解度随温度升高而增大。回答下列问题:
(1)提高“酸浸”速率的方法有
(2)基态
 原子的核外电子排布式为
原子的核外电子排布式为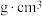 (用含NA和a的代数式表示)。
(用含NA和a的代数式表示)。
(3)黄钠铁矾的化学式为
 ,“除铁”的离子方程式为
,“除铁”的离子方程式为(4)“除钙镁”时,随
 降低,
降低, 用量急剧增加,原因是
用量急剧增加,原因是 和
和 沉淀完全时,溶液中
沉淀完全时,溶液中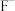 的浓度
的浓度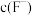 最小为
最小为 。(已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,
。(已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,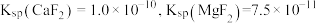 )
)(5)获得
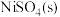 的“一系列操作”是
的“一系列操作”是
您最近一年使用:0次
名校
解题方法
8 . 食盐中加 可预防碘缺乏症。某研究小组制取
可预防碘缺乏症。某研究小组制取 并对其纯度进行测定。
并对其纯度进行测定。
Ⅰ.制取 样品
样品
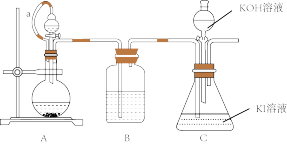
①原理: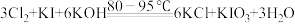
②装置:(C的加热装置已省略)
Ⅱ.分离提纯
①取C中溶液,加入浓盐酸,搅拌冷却,过滤,洗涤,得到 粗产品。
粗产品。
②将 粗产品溶于水,加入KOH调pH至中性,得
粗产品溶于水,加入KOH调pH至中性,得 产品。
产品。
回答下列问题:
(1)用装置A制取氯气,可选择的氧化剂有___________。
(2)橡胶管a的作用是___________ ;该装置的设计缺陷是___________ 。
(3)配制一定浓度KI溶液,下列仪器一定不需要的是___________ (填仪器名称)。

(4)装置C中溶液有KI剩余,加入浓盐酸会导致 产率偏小,原因是
产率偏小,原因是___________ (用离子方程式表示)。
III.测定 产品纯度
产品纯度
a.取 产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用
产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用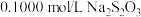 标准液滴定至终点,测得消耗标准液的平均体积为VmL。
标准液滴定至终点,测得消耗标准液的平均体积为VmL。
b.不加 产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗
产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗 标准液的平均体积为
标准液的平均体积为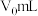 。(已知:
。(已知: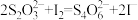 )
)
(5)步骤a中滴定终点的现象是___________ 。
(6)计算该 样品的纯度:
样品的纯度:___________ (填数学表达式)。
 可预防碘缺乏症。某研究小组制取
可预防碘缺乏症。某研究小组制取 并对其纯度进行测定。
并对其纯度进行测定。Ⅰ.制取
 样品
样品
①原理:
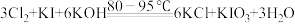
②装置:(C的加热装置已省略)
Ⅱ.分离提纯
①取C中溶液,加入浓盐酸,搅拌冷却,过滤,洗涤,得到
 粗产品。
粗产品。②将
 粗产品溶于水,加入KOH调pH至中性,得
粗产品溶于水,加入KOH调pH至中性,得 产品。
产品。回答下列问题:
(1)用装置A制取氯气,可选择的氧化剂有___________。
| A.高锰酸钾 | B.二氧化锰 | C.氯酸钾 | D.氯化钾 |
(3)配制一定浓度KI溶液,下列仪器一定不需要的是

(4)装置C中溶液有KI剩余,加入浓盐酸会导致
 产率偏小,原因是
产率偏小,原因是III.测定
 产品纯度
产品纯度a.取
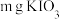 产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用
产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用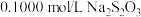 标准液滴定至终点,测得消耗标准液的平均体积为VmL。
标准液滴定至终点,测得消耗标准液的平均体积为VmL。b.不加
 产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗
产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗 标准液的平均体积为
标准液的平均体积为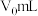 。(已知:
。(已知: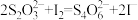 )
)(5)步骤a中滴定终点的现象是
(6)计算该
 样品的纯度:
样品的纯度:
您最近一年使用:0次
名校
9 . 某溶液的主要成分为NaClO(含有一定量的NaOH),既能杀菌消毒又能漂白。下列用来解释事实的离子方程式不正确的是
| A.该溶液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=Cl-+ClO-+H2O |
| B.该溶液与洁厕灵(主要成分为HCl)混合产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O |
| C.该溶液与过氧化氢溶液混合产生O2:2ClO-+H2O2=2Cl-+O2↑+2OH- |
| D.该溶液加白醋可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- |
您最近一年使用:0次
2023-05-31更新
|
842次组卷
|
5卷引用:广东省梅州市丰顺中学2024届高三下学期模拟试卷(四)化学试题
广东省梅州市丰顺中学2024届高三下学期模拟试卷(四)化学试题广东省广州市天河区2023届高三下学期三模化学试题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
10 . 除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
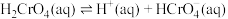

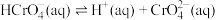
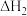
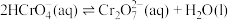

①室温下,反应
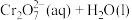 的
的
________ (用含 、
、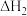 或
或 的代数式表示)。
的代数式表示)。
②基态 核外电子排布式为
核外电子排布式为________ 。
③室温下,初始浓度为 的
的 溶液中
溶液中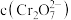 随
随 的变化如图所示。
的变化如图所示。
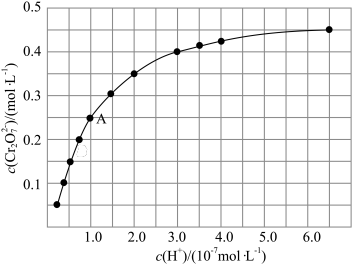
根据A点数据计算反应
 的
的
_________ ,下列关于该反应的说法不正确的是_________ 。
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为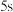 ,则
,则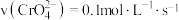
C.若升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2) 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。
①实验中的 作用是
作用是________ 。
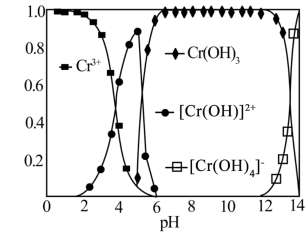
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为_________ 。
(3)微生物法:
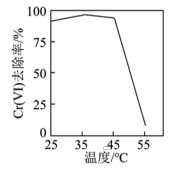
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。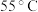 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是____________ 。
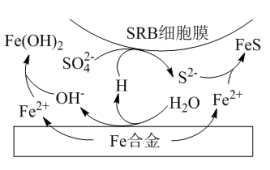
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为 ,
, 得到电子转化为H,
得到电子转化为H,________ 。
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:
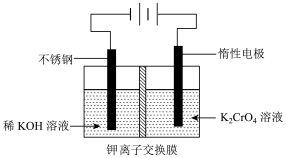
①该制备过程总反应的化学方程式为____________ 。
②电解一段时间后,阳极区溶液中 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为___________  。
。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
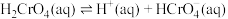

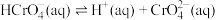
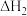
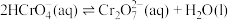

①室温下,反应

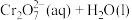 的
的
 、
、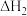 或
或 的代数式表示)。
的代数式表示)。②基态
 核外电子排布式为
核外电子排布式为③室温下,初始浓度为
 的
的 溶液中
溶液中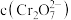 随
随 的变化如图所示。
的变化如图所示。
根据A点数据计算反应

 的
的
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为
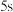 ,则
,则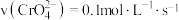
C.若升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2)
 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。①实验中的
 作用是
作用是②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当
 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。
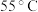 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为
 ,
, 得到电子转化为H,
得到电子转化为H,
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:

①该制备过程总反应的化学方程式为
②电解一段时间后,阳极区溶液中
 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为 。
。
您最近一年使用:0次



