名校
解题方法
1 . 已知电离常数:Ka(HCN)=5×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,下列离子方程式书写正确的是
A.向KCN(aq)中通入少量的CO2气体:CO2+H2O+2CN-=2HCN+CO |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.氢氧化铁沉淀溶解于过量氢碘酸溶液中:2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2 |
D.向Ba(OH)2溶液中加入少量的NaHCO3溶液:2HCO +Ba2++2OH-=BaCO3↓+CO +Ba2++2OH-=BaCO3↓+CO +2H2O +2H2O |
您最近一年使用:0次
2023-06-18更新
|
1745次组卷
|
8卷引用:2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题
2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题河南省郑州外国语学校2023届高三下学期全真模拟五理综化学试题(已下线)第九章单元测试卷(已下线)考点1 电离平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)电离平衡江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题2024届湖南省长沙市雅礼中学高三下学期4月综合测试化学试题湖南省雅礼中学2024届高三下学期综合自主压轴测试 (一)化学题
名校
解题方法
2 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
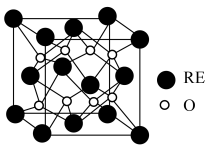
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
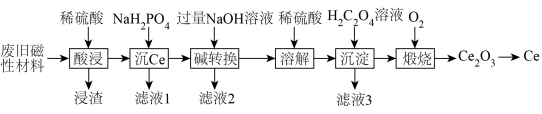
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近一年使用:0次
2024-03-31更新
|
1063次组卷
|
4卷引用:2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题
2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题2024届广东省肇庆市高三上学期二模化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(广东卷02)-2024年高考押题预测卷
3 . Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
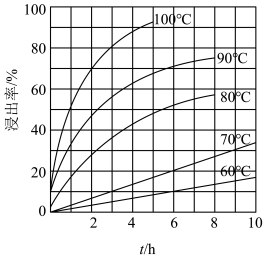
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为____________________________ 。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式____________________ 。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
分析40℃时TiO2·xH2O转化率最高的原因_______________________________________ 。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为___________ 。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成______________ (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式____________ 。

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式
您最近一年使用:0次
2017-08-09更新
|
12690次组卷
|
23卷引用:广东省梅州市梅江区梅州中学2021-2022学年高三下学期开学模拟考试化学试题
广东省梅州市梅江区梅州中学2021-2022学年高三下学期开学模拟考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)重庆市第二中学2018届高三3月测试化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题吉林省四平四中2019届高三下学期第二次模拟考试化学试题四川省成都实验高级中学2020届高三上学期入学考试化学试题四川省棠湖中学2020届高三10月月考理综化学试题2020届高考化学二轮复习大题精准训练——化学工艺流程专题百所名校联考-化学实验综合题型云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)广东省华南师范大学附属中学2021-2022学年高三上学期1月模拟考试化学试题河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题
名校
4 . 某溶液的主要成分为NaClO(含有一定量的NaOH),既能杀菌消毒又能漂白。下列用来解释事实的离子方程式不正确的是
| A.该溶液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=Cl-+ClO-+H2O |
| B.该溶液与洁厕灵(主要成分为HCl)混合产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O |
| C.该溶液与过氧化氢溶液混合产生O2:2ClO-+H2O2=2Cl-+O2↑+2OH- |
| D.该溶液加白醋可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- |
您最近一年使用:0次
2023-05-31更新
|
842次组卷
|
5卷引用:广东省梅州市丰顺中学2024届高三下学期模拟试卷(四)化学试题
广东省梅州市丰顺中学2024届高三下学期模拟试卷(四)化学试题广东省广州市天河区2023届高三下学期三模化学试题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
5 . 除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
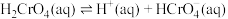

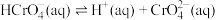
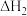
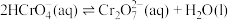

①室温下,反应
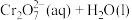 的
的
________ (用含 、
、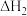 或
或 的代数式表示)。
的代数式表示)。
②基态 核外电子排布式为
核外电子排布式为________ 。
③室温下,初始浓度为 的
的 溶液中
溶液中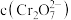 随
随 的变化如图所示。
的变化如图所示。
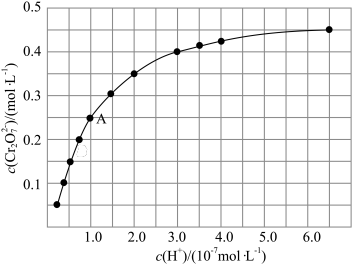
根据A点数据计算反应
 的
的
_________ ,下列关于该反应的说法不正确的是_________ 。
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为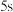 ,则
,则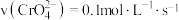
C.若升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2) 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。
①实验中的 作用是
作用是________ 。
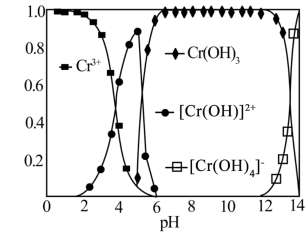
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为_________ 。
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。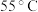 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是____________ 。
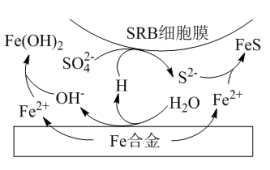
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为 ,
, 得到电子转化为H,
得到电子转化为H,________ 。
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:
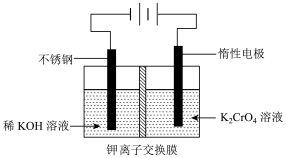
①该制备过程总反应的化学方程式为____________ 。
②电解一段时间后,阳极区溶液中 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为___________  。
。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
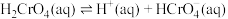

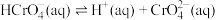
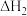
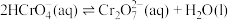

①室温下,反应

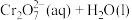 的
的
 、
、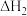 或
或 的代数式表示)。
的代数式表示)。②基态
 核外电子排布式为
核外电子排布式为③室温下,初始浓度为
 的
的 溶液中
溶液中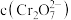 随
随 的变化如图所示。
的变化如图所示。
根据A点数据计算反应

 的
的
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为
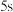 ,则
,则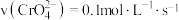
C.若升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2)
 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。①实验中的
 作用是
作用是②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当
 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。
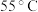 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为
 ,
, 得到电子转化为H,
得到电子转化为H,
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:

①该制备过程总反应的化学方程式为
②电解一段时间后,阳极区溶液中
 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为 。
。
您最近一年使用:0次
名校
6 . Cl2在70℃的NaOH水溶液中自身发生氧化还原反应,完全反应后,测得溶液中有NaCl、NaClO、NaClO3,其中NaClO与NaClO3的个数之比为4︰1,则溶液中NaCl与NaClO的个数之比为
| A.1︰1 | B.5︰4 | C.9︰4 | D.11︰2 |
您最近一年使用:0次
2022-09-11更新
|
1144次组卷
|
7卷引用:广东省大埔县虎山中学2022-2023学年高一上学期(11月)期中考试化学试题
名校
7 . 回答下列问题:
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是_______ (填化学式,下同); 被还原的元素是_______ ;氧化产物是_______ 。
②若有 96克 Cu 参与反应时,则生成的NO质量为_______ g。
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目_____ 。
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是_______ 。
②写出该反应的化学方程式_______ 。
(1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2+2NO↑ + 4H2O。
①反应中还原剂是
②若有 96克 Cu 参与反应时,则生成的NO质量为
(2)配平下列方程式,并在所给方程式上用单线桥法标出电子转移的方向和数目
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
(3)某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2 →O2。
①该反应中的氧化剂是
②写出该反应的化学方程式
您最近一年使用:0次
8 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态,可以对物质的性质进行解释和预测。
Ⅰ、有三种物质: 、
、 、
、
(1)其中氧元素的化合价均为___________ 价。
(2)从氧化剂和还原剂的角度,分析反应中的 作用。请完成下表内容。
作用。请完成下表内容。
(3)由 、
、 的名称可推知
的名称可推知 的名称为
的名称为___________ 。
(4)已知 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式___________ ,由此可推测 也可做供氧剂。
也可做供氧剂。
II、亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。
(5)误食 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。
(6)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过150毫克,以此计算,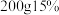 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠___________ 千克。
(7)亚硝酸钠在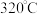 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目___________ 。

Ⅰ、有三种物质:
 、
、 、
、
(1)其中氧元素的化合价均为
(2)从氧化剂和还原剂的角度,分析反应中的
 作用。请完成下表内容。
作用。请完成下表内容。| 序号 | 化学反应方程式 | 作用 |
| ① |  | |
| ② |  | |
| ③ | 既作氧化剂,又作还原剂 |
(3)由
 、
、 的名称可推知
的名称可推知 的名称为
的名称为(4)已知
 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式 也可做供氧剂。
也可做供氧剂。II、亚硝酸钠
 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。(5)误食
 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。A. 被还原 被还原 | B.维生素 具有还原性 具有还原性 |
C.还原性:维生素 | D. 是还原剂 是还原剂 |
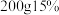 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠(7)亚硝酸钠在
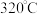 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
您最近一年使用:0次
2022-10-23更新
|
512次组卷
|
2卷引用:广东省兴宁市齐昌中学2022-2023学年高一上学期期中考试化学试题
9 . 下列离子方程式正确且与所给事实相符的是
A.某电子厂制作印刷电路板: |
B.用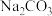 溶液除去锅炉水垢中的 溶液除去锅炉水垢中的 : :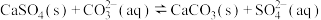 |
C.混用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)会发生氯气中毒: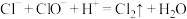 |
D.用 作抗胃酸药: 作抗胃酸药: |
您最近一年使用:0次
名校
10 . 酸性条件下,用 进行脱硫处理的原理如下图所示。下列说法中,
进行脱硫处理的原理如下图所示。下列说法中,不正确 的是
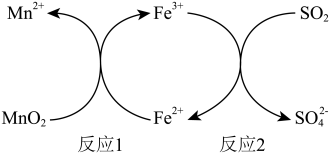
 进行脱硫处理的原理如下图所示。下列说法中,
进行脱硫处理的原理如下图所示。下列说法中,
A.反应1中 做氧化剂 做氧化剂 | B.反应1的产物有 |
C.反应2中 做还原剂 做还原剂 | D.反应2中 做反应物 做反应物 |
您最近一年使用:0次
2023-07-18更新
|
399次组卷
|
5卷引用:广东省梅州市梅江区梅州中学2023-2024学年高一上学期第一次月考化学试题



