1 . 市政污泥含大量金属(Cu、Zn、Ni、Fe、Ag等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(ZnSO4·7H2O)的工艺流程如下:
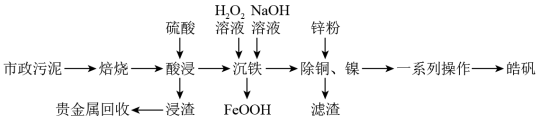
已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有___________ (任写一条)。
(2)“一系列操作”主要包括___________ 、___________ 、过滤、洗涤,干燥。
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为___________ 。
(4)“浸渣”中含有Ag2S,经一系列处理得Ag(NH3)2Cl(可溶于水,电离成[Ag(NH3)2]+和Cl-},用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:_______ ,则反应中氧化剂与还原剂的物质的量之比为_______ 。
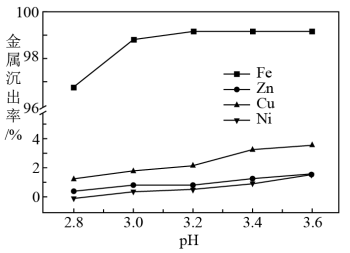
(5)浸出液中含有Fe2+,“沉铁”步骤中发生反应的离子方程式为_______ 。pH对不同金属沉出率的影响如图所示,则“沉铁’时最合理的pH约为_______ 。在pH<6时,Zn2+、Cu2+、Ni2+在溶液中以离子形式存在,但是有铁离子存在时,pH升高,Zn、Cu、Ni损失率均升高,原因可能是_______ 。

已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)“一系列操作”主要包括
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
(4)“浸渣”中含有Ag2S,经一系列处理得Ag(NH3)2Cl(可溶于水,电离成[Ag(NH3)2]+和Cl-},用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:
(5)浸出液中含有Fe2+,“沉铁”步骤中发生反应的离子方程式为

您最近一年使用:0次
2022-01-11更新
|
1500次组卷
|
5卷引用:广东省清远市2021-2022学年高三上学期期末教学质量检测化学试题
名校
2 . 硫化氢(H2S)是一种无色、有臭鸡蛋气味的有毒气体。处理某废气中的 H2S,是将废气与空气混合通入 FeCl2,CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是
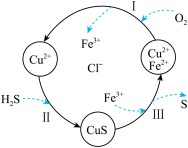

| A.转化过程中参与循环的离子只有 Cu2+、Fe2+ |
| B.转化过程有两种元素的化合价发生了变化 |
| C.氧化性由强到弱的顺序:S>Fe3+>O2 |
| D.过程Ⅲ中发生反应的离子方程式为 CuS+2Fe3+=S+2Fe2++Cu2+ |
您最近一年使用:0次
2023-11-01更新
|
453次组卷
|
12卷引用:广东省清远市名校2023-2024学年高一上学期期中调研联考化学试题
广东省清远市名校2023-2024学年高一上学期期中调研联考化学试题重庆市2021-2022学年高一上学期期末联合检测化学试题广东省广州市第五中学2022-2023学年高一上学期段考试化学试题陕西省西安市铁一中2022-2023学年高一上学期第一次月考化学试题广东省广州市第五中学2022-2023学年高一上学期期中考试化学试题湖北省麻城市实验高级中学2021-2022学年高一下学期2月迎春考化学试题四川省达州天立学校2022-2023学年高一上学期第一次月考选科摸底测试学试题【2022】【高一上】【长河高级中学】【期中考】【高中化学】吉林省长春市第二实验中学2023-2024学年高一上学期期中考试化学试题安徽省阜阳市临泉第一中学2023-2024学年高一上学期10月月考化学试题云南会泽县实验高级中学校2023-2024学年高一上学期10月月考化学试题安徽省合肥市第三中学2023-2024学年高一上学期12月份学情调研化学试题
3 . 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的离子方程式书写错误的是
A.将KI溶液滴入稀硫酸酸化的KIO3溶液中:5I-+ +6H+=3I2+3H2O +6H+=3I2+3H2O |
B.过量铁粉与稀硝酸反应:Fe+4H++ =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
C.用酸性KMnO4溶液吸收含SO2尾气:5SO2+2 +2H2O=2Mn2++4H++5 +2H2O=2Mn2++4H++5 |
D.用碳酸钠溶液浸泡处理锅炉水垢(主要成分为CaSO4):CaSO4(s)+ (aq)⇌CaCO3(s)+ (aq)⇌CaCO3(s)+ (aq) (aq) |
您最近一年使用:0次
2022-01-11更新
|
413次组卷
|
4卷引用:广东省清远市2021-2022学年高三上学期期末教学质量检测化学试题
广东省清远市2021-2022学年高三上学期期末教学质量检测化学试题河北省邢台市名校联盟2021-2022学年高三上学期期末测试化学试题 (已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)(已下线)2022年浙江1月高考真题变式题(11-20)
4 . 如图所示是蒽(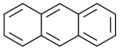 )氧化为蒽醌(
)氧化为蒽醌(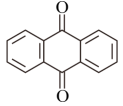 )的间接合成示意图。下列说法错误的是
)的间接合成示意图。下列说法错误的是

 )氧化为蒽醌(
)氧化为蒽醌( )的间接合成示意图。下列说法错误的是
)的间接合成示意图。下列说法错误的是
A.电解槽中,阳极附近溶液的 浓度升高 浓度升高 |
B.1 mol蒽被完全氧化成蒽醌转移电子数目为 |
| C.活性炭的作用是吸收有机物 |
D.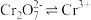 化学再生过程,对环境是友好的 化学再生过程,对环境是友好的 |
您最近一年使用:0次
5 . 根据下列实验设计,回答问题:
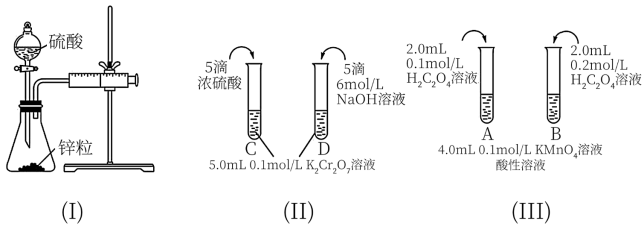
(1)利用实验(Ⅰ)探究锌与0.1 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:___________ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知: (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___________ ,推测该实验设计能否达到实验目的并描述判断理由:___________ 。
(4)某小组也用酸性KMnO4溶液和草酸( )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:
①实验i、实验ii可得出的结论是___________ 。
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
提供试剂:0.01 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。
补全实验iii的操作:向试管中先加入5 0.01
0.01 酸性
酸性 溶液,
溶液,___________ ,最后加入5 0.1
0.1 草酸溶液。
草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1
 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:
 (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(
 )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入1滴3 溶液,再加入1滴3 硫酸和9滴蒸馏水,最后加入5 硫酸和9滴蒸馏水,最后加入5 0.1 0.1 草酸溶液 草酸溶液 | 前10 内溶液紫色无明显变化,后颜色逐渐变浅,30 内溶液紫色无明显变化,后颜色逐渐变浅,30 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入10滴3 溶液,再加入10滴3 硫酸,最后加入5 硫酸,最后加入5 0.1m 0.1m 草酸溶液 草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。提供试剂:0.01
 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。补全实验iii的操作:向试管中先加入5
 0.01
0.01 酸性
酸性 溶液,
溶液, 0.1
0.1 草酸溶液。
草酸溶液。
您最近一年使用:0次
2021-11-05更新
|
379次组卷
|
4卷引用:广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题
名校
6 . 某离子反应涉及 H2O、ClO-、 NH 、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
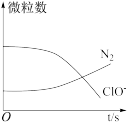
 、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
、OH-、N2、Cl- 等微粒,其中 N2、ClO- 的数目随时间变化的曲线如图所示,下列说法错误的是
| A.该反应中Cl-为还原产物 | B.消耗1个还原剂微粒,转移6 个电子 |
C.NH 被ClO- 氧化成N2 被ClO- 氧化成N2 | D.反应后溶液的碱性减弱 |
您最近一年使用:0次
2023-11-01更新
|
153次组卷
|
3卷引用:广东省清远市名校2023-2024学年高一上学期期中调研联考化学试题
名校
解题方法
7 . 硫铁矿(主要成分为FeS2)是重要的矿产资源,以硫铁矿为原料制备氯化铁晶体(FeCl3∙6H2O)和亚硫酸钠和亚硫酸氢钠的工艺流程如下:
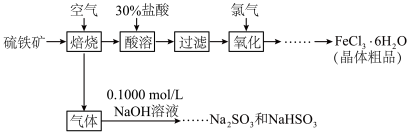
(1)已知: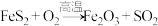 ,请写出配平的反应方程式
,请写出配平的反应方程式____
(2)通氯气氧化的目的是____ ;
(3)气体的主要成分是 ,实验室中可用
,实验室中可用 溶液回收将
溶液回收将 气体通入到
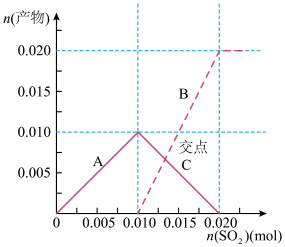
气体通入到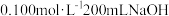 溶液中,溶液中含硫元素的离子的物质的量与
溶液中,溶液中含硫元素的离子的物质的量与 的通入量的关系如图:实线A是
的通入量的关系如图:实线A是__ 的变化曲线,虚线B是___ 的变化曲线(填离子符号)交点C处发生反应的离子方程式为___ 。
(4)实验室用 固体配制240mL0.100mol∙L-1的
固体配制240mL0.100mol∙L-1的 溶液,需要的仪器有
溶液,需要的仪器有___ 、烧杯、玻璃棒、天平。
(5)下列配制的溶液浓度偏高的是___ ;
A.称量 时,称量时间较长
时,称量时间较长
B.配制前,容量瓶中有少量蒸馏水
C.配制时, 未冷却直接定容
未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线F.加蒸馏水时不慎相过了刻度线

(1)已知:
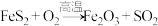 ,请写出配平的反应方程式
,请写出配平的反应方程式(2)通氯气氧化的目的是
(3)气体的主要成分是
 ,实验室中可用
,实验室中可用 溶液回收将
溶液回收将 气体通入到
气体通入到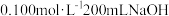 溶液中,溶液中含硫元素的离子的物质的量与
溶液中,溶液中含硫元素的离子的物质的量与 的通入量的关系如图:实线A是
的通入量的关系如图:实线A是
(4)实验室用
 固体配制240mL0.100mol∙L-1的
固体配制240mL0.100mol∙L-1的 溶液,需要的仪器有
溶液,需要的仪器有(5)下列配制的溶液浓度偏高的是
A.称量
 时,称量时间较长
时,称量时间较长B.配制前,容量瓶中有少量蒸馏水
C.配制时,
 未冷却直接定容
未冷却直接定容D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线F.加蒸馏水时不慎相过了刻度线
您最近一年使用:0次
2021-03-26更新
|
311次组卷
|
2卷引用:广东省清远市凤霞中学2020-2021学年高一下学期期中质量检测化学试题
名校
解题方法
8 . 钠是一种非常活泼,具有广泛应用的金属。
(1)钠的原子结构示意图为_______ 。
(2)金属钠非常活泼,通常保存在_______ 里,以隔绝空气。
(3) 、
、 、
、 、
、 久置于空气中最终都变为
久置于空气中最终都变为_______ (填化学式)。
(4)将 投入
投入 溶液中发生反应的现象有
溶液中发生反应的现象有_______ 。
(5)汽车安全气囊的气体发生剂NaN3可由金属钠生产。某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。
i.当汽车发生较严重的碰撞时,受热分解为Na和N2,其化学方程式为_______ ;
ii.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是_______ ;
(1)钠的原子结构示意图为
(2)金属钠非常活泼,通常保存在
(3)
 、
、 、
、 、
、 久置于空气中最终都变为
久置于空气中最终都变为(4)将
 投入
投入 溶液中发生反应的现象有
溶液中发生反应的现象有(5)汽车安全气囊的气体发生剂NaN3可由金属钠生产。某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。
i.当汽车发生较严重的碰撞时,受热分解为Na和N2,其化学方程式为
ii.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是
您最近一年使用:0次
名校
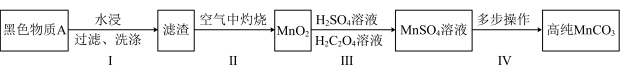
9 . 废旧锌锰干电池内部的黑色物质A主要含有MnO2、MnOOH、NH4C1、ZnCl2、碳单质,用黑色物质A制备高纯MnCO3的流程如图:
已知: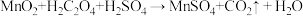 (未配平)。
(未配平)。
(1)第I步操作是为了除去可溶性的_____ (填化学式)。
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为MnO2,另一个是_____ 。灼烧时,MnOOH与空气中的氧气反应的化学方程式为_____ 。
(3)第Ⅲ步中为提高反应速率,可以采取的措施有_____ (任写一条),第Ⅲ步过程中加入H2SO4溶液的作用是_____ 。
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn2+在pH大于7.7时,开始转化为Mn(OH)2沉淀。第Ⅳ步中的多步操作可按如图步骤进行:
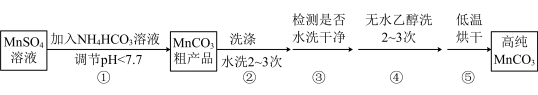
操作①加入NH4HCO3溶液调节溶液pH的过程中有CO2产生,则MnSO4溶液与NH4HCO3溶液反应的离子方程式为_____ ;操作②中需要的玻璃仪器有_____ ;你认为操作③中检测的方法及现象是_____ 时可继续进行操作④;操作④中用无水乙醇洗涤的目的是_____ (答一条即可)。

已知:
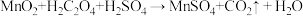 (未配平)。
(未配平)。(1)第I步操作是为了除去可溶性的
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为MnO2,另一个是
(3)第Ⅲ步中为提高反应速率,可以采取的措施有
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn2+在pH大于7.7时,开始转化为Mn(OH)2沉淀。第Ⅳ步中的多步操作可按如图步骤进行:

操作①加入NH4HCO3溶液调节溶液pH的过程中有CO2产生,则MnSO4溶液与NH4HCO3溶液反应的离子方程式为
您最近一年使用:0次
2023-07-05更新
|
170次组卷
|
3卷引用:广东省清远市2022-2023学年高一下学期期末质量检测化学试题
名校
解题方法
10 . 某研究性学习小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略)。已知:Cl2易溶于CCl4而HCl不溶于CCl4

按要求回答问题:
(1)装置A中仪器H的名称是_______ ,写出装置A制取Cl2的化学方程式_______ 。
(2)装置B中的试剂是_______ ,现象是_______ 。装置D和E中出现的不同现象说明氯气没有漂白性,氯水有漂白性。
(3)装置F的作用是_______ 。
(4)有一种“地康法”制取氯气的反应原理如图所示:
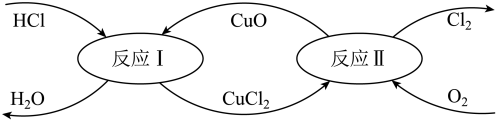
①反应I属于_______ 反应。(填四种基本反应类型之一)
②在450℃条件下,反应II的化学方程式为_______ 。
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:_______ 。

按要求回答问题:
(1)装置A中仪器H的名称是
(2)装置B中的试剂是
(3)装置F的作用是
(4)有一种“地康法”制取氯气的反应原理如图所示:

①反应I属于
②在450℃条件下,反应II的化学方程式为
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:
您最近一年使用:0次



