真题
解题方法
1 . 某工厂采用辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制各
)联合焙烧法制各 和
和 ,工艺流程如下:
,工艺流程如下:
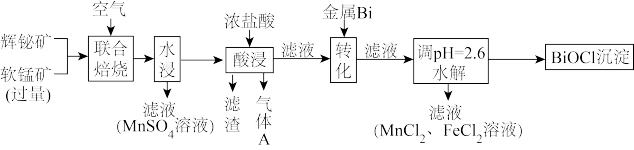
已知:①焙烧时过量的 分解为
分解为 ,
, 转变为
转变为 ;
;
②金属活动性: ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_______ 。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成 ,反应的化学方程式为
,反应的化学方程式为_______ 。
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出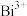 和
和 ;②
;②_______ 。
(4)滤渣的主要成分为_______ (填化学式)。
(5)生成气体A的离子方程式为_______ 。
(6)加入金属Bi的目的是_______ 。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量 产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_______ 。
 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制各
)联合焙烧法制各 和
和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,
, 转变为
转变为 ;
;②金属活动性:
 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
(1)为提高焙烧效率,可采取的措施为
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,反应的化学方程式为
,反应的化学方程式为(3)“酸浸”中过量浓盐酸的作用为:①充分浸出
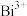 和
和 ;②
;②(4)滤渣的主要成分为
(5)生成气体A的离子方程式为
(6)加入金属Bi的目的是
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量
 产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
您最近半年使用:0次
2022-09-02更新
|
9856次组卷
|
9卷引用:2022年辽宁高考真题化学试题
2022年辽宁高考真题化学试题(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺(已下线)2022年辽宁高考真题化学试题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)河北省涞水北雄高级中学2022-2023学年高三下学期3月月考化学试题
2 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄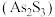 褪色的主要原因是发生了以下两种化学反应:
褪色的主要原因是发生了以下两种化学反应:
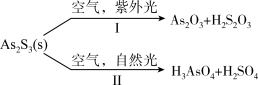
下列说法正确的是
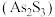 褪色的主要原因是发生了以下两种化学反应:
褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
A. 和 和 的空间结构都是正四面体形 的空间结构都是正四面体形 |
B.反应Ⅰ和Ⅱ中,元素 和S都被氧化 和S都被氧化 |
C.反应Ⅰ和Ⅱ中,参加反应的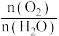 :Ⅰ<Ⅱ :Ⅰ<Ⅱ |
D.反应Ⅰ和Ⅱ中,氧化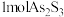 转移的电子数之比为3∶7 转移的电子数之比为3∶7 |
您最近半年使用:0次
2023-06-16更新
|
6483次组卷
|
20卷引用:2023年高考湖南卷化学真题
2023年高考湖南卷化学真题(已下线)专题06 物质结构与性质(已下线)专题09 氧化还原反应(已下线)第3讲 氧化还原反应(已下线)2023年湖南卷高考真题变式题(选择题6-10)浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)河南省商丘市第一高级中学2022-2023学年高二下学期期末考试化学试题江西省吉安市双校联盟2022-2023学年高二下学期期中考试化学试题浙江省义乌五校2023-2024学年高三上学期10月联考化学试题北京大学附属中学预科部2023-2024学年高三上学期10月阶段练习化学试题浙江省三校2023-2024学年高三上学期联考选考模拟化学试题(已下线)题型04 氧化还原反应-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江西省宜春市丰城市第九中学2023-2024学年高一上学期1月期末化学试题(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)河南省济源市高级中学2023-2024学年高三上学期9月高考模拟检测理科综合试题-高中化学山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
真题
解题方法
3 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
的一种制备方法如下图所示: 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为_______ ,生成的沉淀与硝酸反应,生成_______ 后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为_______ ;若反应物用量比 时,氧化产物为
时,氧化产物为_______ ;当 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是_______ 。
(2)以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为_______ 。
(3) 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成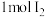 ,消耗的
,消耗的 至少为
至少为_______  。
。 在
在 溶液中可发生反应
溶液中可发生反应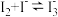 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是_______ 。
(1)
 的一种制备方法如下图所示:
的一种制备方法如下图所示: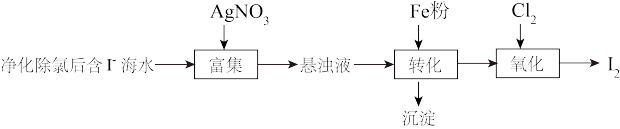
 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为②通入
 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为 时,氧化产物为
时,氧化产物为 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是(2)以
 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为(3)
 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成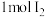 ,消耗的
,消耗的 至少为
至少为 。
。 在
在 溶液中可发生反应
溶液中可发生反应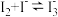 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是
您最近半年使用:0次
2021-06-11更新
|
19564次组卷
|
28卷引用:2021年高考全国甲卷化学真题
2021年高考全国甲卷化学真题(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(二)陌生化学方程式书写(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题天津市第一零二中学2022届高三上学期第一次月考化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)微专题 陌生情景中反应方程式的书写(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第2讲 卤素及海水提溴、提碘(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
4 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
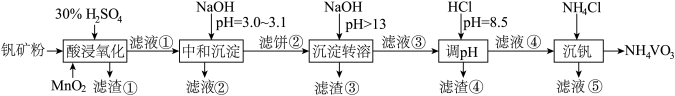
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________ 。
(2)“酸浸氧化”中,VO+和VO2+被氧化成 ,同时还有
,同时还有___________ 离子被氧化。写出VO+转化为 反应的离子方程式
反应的离子方程式___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、___________ ,以及部分的___________ 。
(4)“沉淀转溶”中,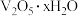 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是___________ 。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________ 。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”需要加热,其原因是
(2)“酸浸氧化”中,VO+和VO2+被氧化成
 ,同时还有
,同时还有 反应的离子方程式
反应的离子方程式(3)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、(4)“沉淀转溶”中,
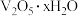 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是
您最近半年使用:0次
2020-07-08更新
|
23315次组卷
|
33卷引用:2020年全国统一考试化学试题(新课标Ⅰ)
2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题15 工艺流程题-2020年高考真题和模拟题化学分项汇编(已下线)第三单元 金属及其化合物测试题-2021年高考化学一轮复习名师精讲练河南省三门峡市第一高级中学2021届高三8月开学考试化学试题福建省福州市第一中学2021届高三上学期开学质检化学试题湖北省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)专题14 无机化工流程不丢分-2021年高考化学必做热点专题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)重点8 工艺流程综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 无机化工流程分析-2021年高考化学专练【热点·重点·难点】(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题(已下线)2021年高考全国乙卷化学试题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题黑龙江省大庆铁人中学2022-2023学年高三上学期开学考试化学试题四川省雅安中学2022-2023学年高二下学期3月月考化学试题(已下线)04 无机化工流程题(4) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)微专题 无机化工流程题的解题策略四川省成都市简阳实验学校2023-2024学年高三下学期开学考试理科综合试题-高中化学
2022高三·全国·专题练习
5 . 以焙烧黄铁矿 (杂质为石英等)产生的红渣为原料制备铵铁蓝
(杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料。工艺流程如下:
颜料。工艺流程如下:
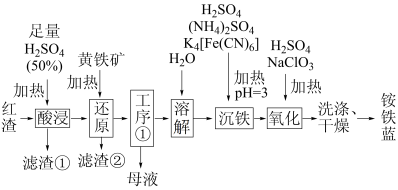
回答下列问题:
(1)红渣的主要成分为_______ (填化学式),滤渣①的主要成分为_______ (填化学式)。
(2)黄铁矿研细的目的是_______ 。
(3)还原工序中,不生成S单质的反应的化学方程式为_______ 。
(4)工序①的名称为_______ ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀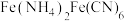 中
中 的化合价为
的化合价为_______ ,氧化工序发生反应的离子方程式为_______ 。
(6)若用还原工序得到的滤液制备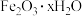 和
和 ,所加试剂为
,所加试剂为_______ 和_______ (填化学式,不引入杂质)。
 (杂质为石英等)产生的红渣为原料制备铵铁蓝
(杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料。工艺流程如下:
颜料。工艺流程如下:
回答下列问题:
(1)红渣的主要成分为
(2)黄铁矿研细的目的是
(3)还原工序中,不生成S单质的反应的化学方程式为
(4)工序①的名称为
(5)沉铁工序产生的白色沉淀
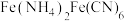 中
中 的化合价为
的化合价为(6)若用还原工序得到的滤液制备
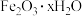 和
和 ,所加试剂为
,所加试剂为
您最近半年使用:0次
2022-07-01更新
|
9941次组卷
|
19卷引用:2022年新高考河北省高考真题化学试题(部分试题)
(已下线)2022年新高考河北省高考真题化学试题(部分试题)2022年河北省高考真题化学试题(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)第09讲 铁及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题17 化工流程综合题-备战2023年高考化学母题题源解密(广东卷)(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺河北省衡水阳光中学2022-2023学年高二上学期第一次阶段考试化学试题(已下线)2022年河北省高考真题变式题(14-18)第一部分 命题热点剖析——知晓高考新方向 剖析工艺流程题命题热点 构建高效解题思维模型(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)陕西省渭南市2023届高三第一次教学质量检测(一模)化学试题(已下线)第6讲 铁及其重要化合物(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题吉林省长春外国语学校2023-2024学年高三上学期9月月考化学试题(已下线)工业流程题
6 . 工业上煅烧含硫矿物产生的 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
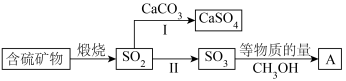
已知: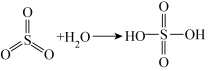
请回答:
(1)富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式___________ 。
(2)煅烧含硫量高的矿物得到高浓度的 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。
①下列说法正确的是___________ 。
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的 也可用浓
也可用浓 吸收
吸收
②一定压强下,化合物A的沸点低于硫酸的原因是___________ 。
(3)设计实验验证化合物A中含有S元素_____ ;写出实验过程中涉及的反应方程式____ 。
 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
已知:
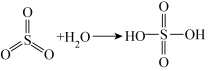
请回答:
(1)富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式(2)煅烧含硫量高的矿物得到高浓度的
 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。①下列说法正确的是
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的
 也可用浓
也可用浓 吸收
吸收②一定压强下,化合物A的沸点低于硫酸的原因是
(3)设计实验验证化合物A中含有S元素
您最近半年使用:0次
真题
名校
7 . 以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4脱硫剂,可用于脱除煤气中的H2S。脱硫剂的制备、硫化、再生过程可表示为
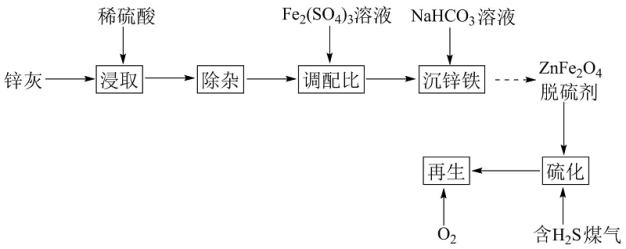
(1)“除杂”包括加足量锌粉、过滤加H2O2氧化等步骤。除Pb2+和Cu2+外,与锌粉反应的离子还有___ (填化学式)。
(2)“调配比”前,需测定ZnSO4溶液的浓度。准确量取2.50mL除去Fe3+的ZnSO4溶液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,滴加氨水调节溶液pH=10,用0.0150mol·L-1EDTA(Na2H2Y)溶液滴定至终点(滴定反应为Zn2++Y4-=ZnY2-),平行滴定3次,平均消耗EDTA溶液25.00mL。计算ZnSO4溶液的物质的量浓度___ (写出计算过程)。
(3)400℃时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器。
①硫化过程中ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为___ 。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,反应前后ZnS的质量不变,该反应过程可描述为___ 。
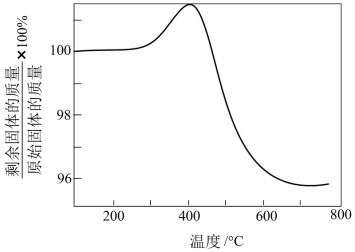
(4)将硫化后的固体在N2:O2=95:5(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是___ 。

(1)“除杂”包括加足量锌粉、过滤加H2O2氧化等步骤。除Pb2+和Cu2+外,与锌粉反应的离子还有
(2)“调配比”前,需测定ZnSO4溶液的浓度。准确量取2.50mL除去Fe3+的ZnSO4溶液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,滴加氨水调节溶液pH=10,用0.0150mol·L-1EDTA(Na2H2Y)溶液滴定至终点(滴定反应为Zn2++Y4-=ZnY2-),平行滴定3次,平均消耗EDTA溶液25.00mL。计算ZnSO4溶液的物质的量浓度
(3)400℃时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器。
①硫化过程中ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,反应前后ZnS的质量不变,该反应过程可描述为
(4)将硫化后的固体在N2:O2=95:5(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是

您最近半年使用:0次
2022-01-04更新
|
6430次组卷
|
8卷引用:2021年新高考江苏化学高考真题
2021年新高考江苏化学高考真题(已下线)黄金卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题江苏省常州高级中学 2022~2023学年高一下学期 5月阶段检测化学试题
真题
解题方法
8 . 实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
,其实验过程可表示为
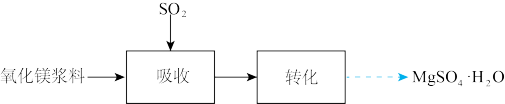
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成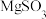 ,反应为
,反应为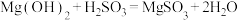 ,其平衡常数K与
,其平衡常数K与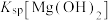 、
、 、
、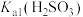 、
、 的代数关系式为
的代数关系式为
___________ ;下列实验操作一定能提高氧化镁浆料吸收 效率的有
效率的有___________ (填序号)。
A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入 气体的速率
气体的速率
D.通过多孔球泡向氧化镁浆料中通
(2)在催化剂作用下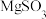 被
被 氧化为
氧化为 。已知
。已知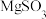 的溶解度为0.57g(20℃),
的溶解度为0.57g(20℃), 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为___________ ;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中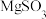 被
被 氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中
氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中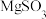 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是___________ 。

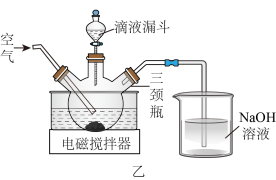
(3)制取 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的
晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的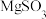 浆料与
浆料与 溶液充分反应。
溶液充分反应。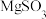 浆料与
浆料与 溶液的加料方式是
溶液的加料方式是___________ ;补充完整制取 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中,___________ 。(已知: 、
、 在
在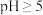 时完全转化为氢氧化物沉淀;室温下从
时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出
饱和溶液中结晶出 ,
, 在150~170℃下干燥得到
在150~170℃下干燥得到 ,实验中需要使用MgO粉末)
,实验中需要使用MgO粉末)
 ,其实验过程可表示为
,其实验过程可表示为
(1)在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成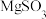 ,反应为
,反应为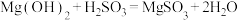 ,其平衡常数K与
,其平衡常数K与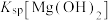 、
、 、
、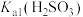 、
、 的代数关系式为
的代数关系式为
 效率的有
效率的有A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入
 气体的速率
气体的速率D.通过多孔球泡向氧化镁浆料中通

(2)在催化剂作用下
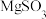 被
被 氧化为
氧化为 。已知
。已知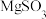 的溶解度为0.57g(20℃),
的溶解度为0.57g(20℃), 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为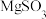 被
被 氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中
氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中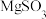 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是
(3)制取
 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的
晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的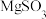 浆料与
浆料与 溶液充分反应。
溶液充分反应。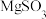 浆料与
浆料与 溶液的加料方式是
溶液的加料方式是 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中, 、
、 在
在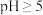 时完全转化为氢氧化物沉淀;室温下从
时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出
饱和溶液中结晶出 ,
, 在150~170℃下干燥得到
在150~170℃下干燥得到 ,实验中需要使用MgO粉末)
,实验中需要使用MgO粉末)
您最近半年使用:0次
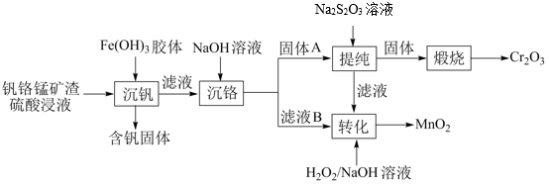
9 . 从钒铬锰矿渣(主要成分为 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
已知:pH较大时,二价锰[ ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
(1)Cr元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数[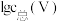 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中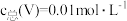 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。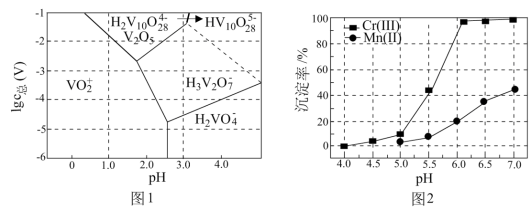
(4)某温度下,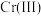 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为_______ ;在该条件下滤液B中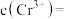
_______  【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。
(5)“转化”过程中生成 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
已知:pH较大时,二价锰[
 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:(1)Cr元素位于元素周期表第
(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数[
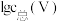 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中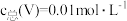 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为
(4)某温度下,
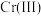 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为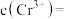
 【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。(5)“转化”过程中生成
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近半年使用:0次
2021-09-13更新
|
10292次组卷
|
15卷引用:2021年新高考辽宁化学高考真题
2021年新高考辽宁化学高考真题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题2021年辽宁高考化学试题变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)05 无机化工流程题(5) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
真题
解题方法
10 . 化合物X由三种元素组成,某学习小组按如下流程进行实验:
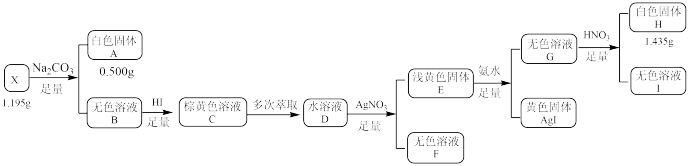
已知:白色固体A用 溶解后,多余的酸用
溶解后,多余的酸用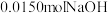 恰好中和,请回答:
恰好中和,请回答:
(1)X的组成元素是___________ ,X的化学式是___________ 。
(2)写出 溶液呈棕黄色所发生的化学反应方程式
溶液呈棕黄色所发生的化学反应方程式___________ 。
(3)写出生成白色固体H的离子方程式___________ 。
(4)设计实验检验溶液Ⅰ中的阳离子___________ 。

已知:白色固体A用
 溶解后,多余的酸用
溶解后,多余的酸用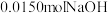 恰好中和,请回答:
恰好中和,请回答:(1)X的组成元素是
(2)写出
 溶液呈棕黄色所发生的化学反应方程式
溶液呈棕黄色所发生的化学反应方程式(3)写出生成白色固体H的离子方程式
(4)设计实验检验溶液Ⅰ中的阳离子
您最近半年使用:0次



