名校
解题方法
1 . 硫酸铜可用于游泳池消毒,工业上一种利用含铜矿石(主要含 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示:
(1)为了提高“焙烧”的反应速率,可采取的措施为__________ (任写一种即可)。
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、 ),
), 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
(3)“酸溶”后,溶液中的金属阳离子有__________ ;“滤渣a”用途为__________ (任写一点即可)。
(4)“转化”时发生反应的离子方程式为__________ ,不能将双氧水替换为硝酸的原因是__________ ,“一系列操作”包括蒸发浓缩、__________ 、过滤、干燥。
(5)硫酸铜晶体(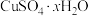 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为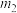 ,则结晶水
,则结晶水
__________ (用字母表示)。
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为 ,晶胞参数为
,晶胞参数为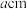 。
。
①O的配位数为__________ 。
②阿伏加德罗常数=__________ (用含 、a的字母表示)。
、a的字母表示)。
 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示: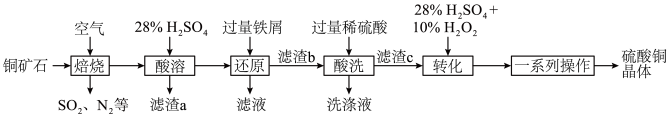
(1)为了提高“焙烧”的反应速率,可采取的措施为
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、
 ),
), 发生反应的化学方程式为
发生反应的化学方程式为(3)“酸溶”后,溶液中的金属阳离子有
(4)“转化”时发生反应的离子方程式为
(5)硫酸铜晶体(
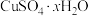 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为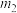 ,则结晶水
,则结晶水
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为
 ,晶胞参数为
,晶胞参数为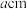 。
。①O的配位数为
②阿伏加德罗常数=
 、a的字母表示)。
、a的字母表示)。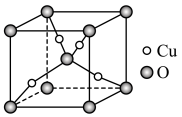
您最近半年使用:0次
名校
解题方法
2 . 二氧化硫是最常见、最简单、有刺激性的硫氧化物,大气主要污染物之一,火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。SO2在生活、生产中有重要用途,使用不当会造成环境污染。
(1)某同学利用如图所示装置研究二氧化硫的性质。___________ ,加入药品前需要___________ 。
②实验开始前先通入一段时间N2,此操作的目的是___________ 。
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有___________ 性。
④装置c中的溶液___________ (填能或不能)用澄清石灰水替换,理由是___________ 。
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。___________ 。该空气中二氧化硫的体积分数为___________ 。
(1)某同学利用如图所示装置研究二氧化硫的性质。

②实验开始前先通入一段时间N2,此操作的目的是
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有
④装置c中的溶液
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。

您最近半年使用:0次
名校
3 . 氮及其化合物与生产生活及环境息息相关。请回答下列问题:
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:___________ 。
(2)硝酸与金属反应会产生氮氧化物。下列环境问题与氮的氧化物排放无关的是___________ 。
A酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式___________ ,氧化产物与还原产物的物质的量之比为___________ 。
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(HSbF6),称为超强酸。氟锑酸可由SbF5与HF混合得到。制备氟锑酸一般在塑料容器中进行,不在玻璃仪器中进行的原因是___________ (用化学方程式回答)
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:
(2)硝酸与金属反应会产生氮氧化物。下列环境问题与氮的氧化物排放无关的是
A酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(HSbF6),称为超强酸。氟锑酸可由SbF5与HF混合得到。制备氟锑酸一般在塑料容器中进行,不在玻璃仪器中进行的原因是
您最近半年使用:0次
名校
4 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为___________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2 +H2O
+H2O
2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2
 +H2O
+H2O2NO2+2OH-=
 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。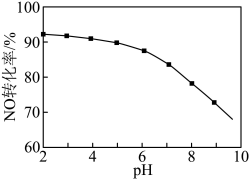
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近半年使用:0次
名校
5 . 氰化氢(HCN,一元弱酸,易挥发)主要应用于电镀、采矿、药物合成等工业生产。HCN,CN-能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,___________ 。
(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是___________ 。
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是___________ 。 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g) NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0
除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是___________ 。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是
 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是
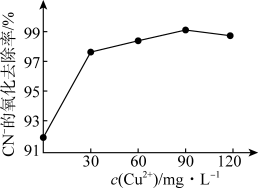
 ,其反应的离子方程式为
,其反应的离子方程式为(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g)
 NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是

您最近半年使用:0次
名校
解题方法
6 . V2O5(五氧化二钒)可作化学工业中的催化剂。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
②部分含钒物质常温下在水中的溶解性如表所示:
③ +2OH-
+2OH-
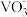 +H2O
+H2O
回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为___________ 。
(2)在第Ⅱ步中需要加入氨水,请结合 +2OH-
+2OH-
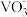 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为___________ 。
(3)需在流动空气中加热NH4VO3的原因可能是___________ 。
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___________ (保留4位有效数字)。(已知:I2+2 Na2S2O3= Na2S4O6+2NaI,写出计算过程)

②部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 +2OH-
+2OH-
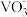 +H2O
+H2O回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为
(2)在第Ⅱ步中需要加入氨水,请结合
 +2OH-
+2OH-
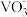 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为(3)需在流动空气中加热NH4VO3的原因可能是
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为
您最近半年使用:0次
解题方法
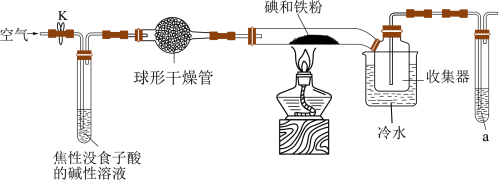
7 . 碘化亚铁(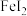 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)_______ ,若无此装置,写出铁粉参与的副反应的化学方程式:_______ ,硬质玻璃管中制备碘化亚铁的化学方程式为_______ 。
(2)硬质玻璃管直接接入收集器而不用导管的原因是_______ ,收集器浸泡在冷水中的原因是_______ 。
(3)试剂a的作用是_______ 。
(4)已知氧化性: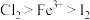 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:_______ 。
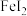 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)
(2)硬质玻璃管直接接入收集器而不用导管的原因是
(3)试剂a的作用是
(4)已知氧化性:
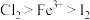 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:
您最近半年使用:0次
8 . Ⅰ.某无色透明溶液中可能大量存在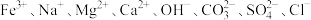 中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
①向第一份溶液中滴入几滴酚酞试液,溶液变红;
②向第二份溶液中加入过量 溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
③向第三份溶液中先加入 溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
已知: 可与水作用,产生较多的
可与水作用,产生较多的 ,使溶液呈碱性;
,使溶液呈碱性; 溶于稀硝酸。
溶于稀硝酸。
(1)根据上述实验现象可知,原溶液中一定存在的离子是_______ ,一定不存在的离子是_______ ,不能确定是否存在的离子是_______ 。
Ⅱ.次磷酸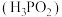 是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的
是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的 还原为银单质,从而用于化学镀银。
还原为银单质,从而用于化学镀银。 的工业制法是将白磷与
的工业制法是将白磷与 溶液反应生成
溶液反应生成 气体和
气体和 ,后者再与
,后者再与 反应生成
反应生成 。
。
(2)写出白磷 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:_______ ,反应中每消耗 ,转移的电子数为
,转移的电子数为_______ 。
(3)写出 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(4)工业上利用 进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中
进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中 元素的化合价为
元素的化合价为_______ 。
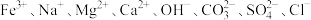 中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:①向第一份溶液中滴入几滴酚酞试液,溶液变红;
②向第二份溶液中加入过量
 溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;③向第三份溶液中先加入
 溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。已知:
 可与水作用,产生较多的
可与水作用,产生较多的 ,使溶液呈碱性;
,使溶液呈碱性; 溶于稀硝酸。
溶于稀硝酸。(1)根据上述实验现象可知,原溶液中一定存在的离子是
Ⅱ.次磷酸
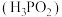 是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的
是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的 还原为银单质,从而用于化学镀银。
还原为银单质,从而用于化学镀银。 的工业制法是将白磷与
的工业制法是将白磷与 溶液反应生成
溶液反应生成 气体和
气体和 ,后者再与
,后者再与 反应生成
反应生成 。
。(2)写出白磷
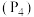 与
与 溶液反应的化学方程式:
溶液反应的化学方程式: ,转移的电子数为
,转移的电子数为(3)写出
 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:(4)工业上利用
 进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中
进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中 元素的化合价为
元素的化合价为
您最近半年使用:0次
解题方法
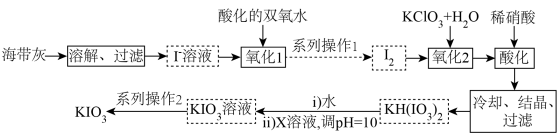
9 . 1833年,布森戈提出用富含碘的盐治疗甲肿,这是第一位提出向盐中添加碘防治甲肿的人。我国政府规定:碘盐添加KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图所示。
(1) KIO3属于__________ (填“酸”“碱”“盐”或“氧化物”),其中I的化合价为__________ 价。
(2)“氧化1”中发生反应的离子方程式为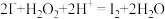 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:______________ ,该氧化过程中需要控制温度不宜过高,其原因是______________ 。系列操作2包括蒸发浓缩_______________ 过滤、乙醇洗涤、干燥等。
(3)X的化学式为______________ 。
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应: (未配平)。
(未配平)。
①根据上述数据,测得产品中碘元素质量分数为__________ (用含w、c、V的表达式表示)。
②如果将稀硫酸换成稀硝酸,则测得结果会__________ (填“偏高”“偏低”或“无影响”)。
(1) KIO3属于
(2)“氧化1”中发生反应的离子方程式为
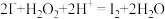 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:(3)X的化学式为
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应:
 (未配平)。
(未配平)。①根据上述数据,测得产品中碘元素质量分数为
②如果将稀硫酸换成稀硝酸,则测得结果会
您最近半年使用:0次
10 . 已知R为短周期主族元素,一种白色钠盐M的组成用通式 表示。为了探究R元素,进行如下实验:
表示。为了探究R元素,进行如下实验:
(1)若在M溶液中滴加 溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为
溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为__________ ,M的俗名是__________ 。
(2)若在M溶液中滴加 溶液,生成白色胶状物质,该白色胶状物质的化学式为
溶液,生成白色胶状物质,该白色胶状物质的化学式为______________ 。
(3)若将M溶液加入酸性 溶液中,酸性
溶液中,酸性 溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是
溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是__________ ,则M溶液和酸性 溶液反应使其溶液褪色的离子方程式为
溶液反应使其溶液褪色的离子方程式为________ ,其中还原剂是__________ 。
(4)若在M溶液中加入铜粉,无明显现象,滴加适量稀硫酸,铜粉溶解,溶液变蓝色,生成气体X,将X与单质Y通入足量水中恰好发生化合反应,则同温同压下X与Y的体积比为________ ,铜粉溶解的离子方程式为____________ ,工业上,氨催化氧化可制备X,其反应的化学方程式为__________ 。
 表示。为了探究R元素,进行如下实验:
表示。为了探究R元素,进行如下实验:(1)若在M溶液中滴加
 溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为
溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为(2)若在M溶液中滴加
 溶液,生成白色胶状物质,该白色胶状物质的化学式为
溶液,生成白色胶状物质,该白色胶状物质的化学式为(3)若将M溶液加入酸性
 溶液中,酸性
溶液中,酸性 溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是
溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是 溶液反应使其溶液褪色的离子方程式为
溶液反应使其溶液褪色的离子方程式为(4)若在M溶液中加入铜粉,无明显现象,滴加适量稀硫酸,铜粉溶解,溶液变蓝色,生成气体X,将X与单质Y通入足量水中恰好发生化合反应,则同温同压下X与Y的体积比为
您最近半年使用:0次



